2019-artikel
Klinische Studien:
Universitäten lassen Transparenz vermissen
Zum Schutz von PatientInnen müssen die Ergebnisse aller klinischen Studien veröffentlicht werden. Doch eine Untersuchung von europäischen Universitäten zeigt, dass viele diese Verpflichtung schlecht erfüllen. Ein gemeinsamer Bericht von BUKO Pharma-Kampagne, TranspariMED (Vereinigtes Königreich), Test Aankoop (Belgien) und Health Action International (Amsterdam) macht gravierende Defizite deutlich. Untersucht wurden die 30 Universitäten, die die meisten Studien durchführen.[1]
Klinische Studienergebnisse nicht zu melden, hat erhebliche negative Konsequenzen für PatientInnen und die öffentliche Gesundheit. Seit Juli 2014 schreibt die Europäische Union (EU) vor, dass für jede klinische Studie, die im EU Clinical Trials Register eingetragen ist, eine Zusammenfassung ihrer Ergebnisse innerhalb von 12 Monaten nach Studienabschluss (sechs Monate für pädiatrische Studien) im europäischen Studienregister veröffentlichen muss. Diese Regulierung trifft auch auf Studien zu, die vor 2014 abgeschlossen wurden und gilt unabhängig davon, ob die Studienergebnisse bereits in der Fachliteratur publiziert wurden. Das bedeutet, dass klinischen Studien, bei denen die Sponsoren keine Zusammenfassung der Ergebnisse im EU-Register veröffentlichten, gegen die Transparenzverordnung der EU verstoßen.
Die Ergebnisse im Überblick
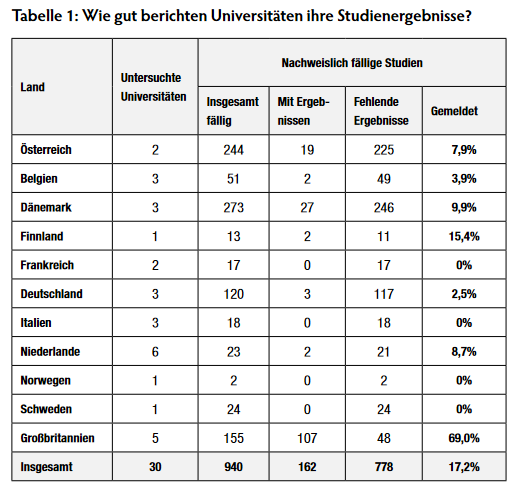
Von den 30 europäischen Universitäten, die die meisten Studien gemeldet haben, fehlen insgesamt nachweisbar Ergebnisse von 778 fälligen klinischen Studien im europäischen Studienregister, das entspricht 83% (Tabelle 1). Lässt man die Universitäten im Vereinigten Königreich außen vor, liegt die Melderate bei lediglich 7%. Die absolute Zahl an fehlenden Ergebnissen von fälligen Studien ist vermutlich deutlich höher.
Nur drei Universitäten schneiden gut ab: University of Oxford, University College London und King’s College London. Diese Einrichtungen haben bereits über 80% ihrer fälligen Studienergebnisse veröffentlicht. 14 der 30 untersuchten Universitäten haben dagegen nicht ein einziges Studienergebnis veröffentlicht. Das trifft auf alle Universitäten in Frankreich, Italien, Norwegen und Schweden zu. Auch die verbliebenen 13 Universitäten schneiden mit Melderaten von 2 – 33% schlecht ab.
Die Tatsache, dass britische Universitäten ihre europäischen Peers mit großem Abstand übertreffen, liegt am Druck des Parlaments, der Forschungsförderer und der Öffentlichkeit. Die starke Performance einiger Universitäten im Vereinigten Königreich zeigt, dass Universitäten in ganz Europa es deutlich besser machen können – und auch müssen.
Empfehlungen
Universitäten sollten die Ergebnisse von allen klinischen Studien – vergangene, gegenwärtige und zukünftige – in allen Registern veröffentlichen, in denen die Studien eingetragen wurden. Bei laufenden und künftigen Studien sollten Universitäten die Ergebnisse innerhalb von zwölf Monaten nach Abschluss veröffentlichen.
Darüber hinaus sollten die Universitäten die gemeinsame Erklärung der International Clinical Trials Registry Platform (ICTRP) der Weltgesundheitsorganisation (WHO)[2] unterzeichnen und die dort beschriebenen Regeln zu Transparenz befolgen.
Nationale Zulassungsbehörden sollten regelmäßig den Status aller Studien überprüfen, die in ihren Registern noch als „laufend“ gelistet sind, und ihren Status – falls erforderlich – in „abgeschlossen“ ändern.
Nationale Forschungsförderer sollten ebenfalls die gemeinsame Erklärung der WHO unterzeichnen, um PatientInnen zu schützen und zu verhindern, dass von SteuerzahlerInnen finanzierte medizinische Forschung wegen Nichtveröffentlichung der Ergebnisse der Studien verschwendet werden.
Nationale Regierungen sollten systematisch kontrollieren, ob klinische Studien, die in ihrem Zuständigkeitsbereich durchgeführt werden, ihre Studienergebnisse in öffentlichen Registern innerhalb von zwölf Monaten veröffentlichen, wie es die Best Practices der WHO vorsehen. Studiensponsoren, die ihre Ergebnisse nicht innerhalb der Frist veröffentlichen, sollten sanktioniert werden. Das Vereinigte Königreich bereitet entsprechende Schritte gegenwärtig vor.
Wie gut sind die Länder?
Dieser Bericht untersucht das Meldeverhalten von den 30 europäischen Universitäten mit den klinischen Studien, die der EU-Verordnung zu klinischen Studien unterliegen. Insgesamt haben diese Universitäten 4.575 klinische Studien gesponsert. Für 940 dieser Studien sind Ergebnisse nachweislich fällig. Allerdings haben lediglich 162 der nachweisbar fälligen Studien (17%) ihre Ergebnisse im EU Clinical Trials Register veröffentlicht. Bei den verbleibenden 778 Studien (83%) verstoßen die Universitäten somit gegen die Transparenzvorschriften der EU.
Die meisten der 778 Studien mit nachweislich fehlender Ergebnisberichterstattung wurden von Universitäten in Dänemark (246 Studien), Österreich (225) und Deutschland (117) durchgeführt. Von den untersuchten Universitäten in Frankreich, Italien, Norwegen und Schweden wurde kein einziges Studienergebnis im Register veröffentlicht. Manche Universitäten in Belgien, Deutschland und den Niederlanden haben ebenfalls für keine ihrer klinischen Studien Ergebnisse veröffentlicht. Nur ein paar britische Universitäten haben gut abgeschnitten, manche Institutionen rühmen sich mittlerweile mit Melderaten über 80%. Schließt man die britischen Universitäten von der Betrachtung aus, liegt die durchschnittliche Melderate in Europa gerade mal bei 7% und somit sogar niedriger als die 11%, die Forscher für europäische Universitäten im September 2018 ermittelt haben. Außerhalb des Vereinigten Königreichs fehlen Ergebnissen zu 730 von 785 nachweisbar fälligen Studien (93%).
In Deutschland
Von den einbezogenen drei deutschen Universitäten schneidet München mit 7% noch am besten ab, die Charité kommt auf 2% und Heidelberg hat kein einziges Ergebnis veröffentlicht. Positiv sticht in Deutschland nur die Uni Münster ab, die nicht unter den Top 30 Forschungsstätten ist (und deshalb in die vorliegende Untersuchung nicht mit einbezogen wurde). Sie hat 58,8% aller Studien veröffentlicht.[3]
Die obenstehenden Zahlen unterschätzen vermutlich signifikant den wahren Anteil an klinischen Studien, die wegen fehlender Veröffentlichung der Ergebnisse gegen die EU Regeln verstoßen. Das liegt daran, dass zahlreiche Studien als „laufend“ im europäischen Studienregister gelistet werden, obwohl sie schon längst abgeschlossen sind. Zum Beispiel haben Universitäten in den Niederlanden insgesamt 967 Studien durchgeführt, aber nur 23 davon (2,4%) sind als „abgeschlossen“ gekennzeichnet. Dieser geringe Anteil ist nicht plausibel, da die Registereinträge zeigen, dass viele dieser Studien vor über fünf Jahren begonnen wurden. Im Vereinigten Königreich, wo das nationale Register gerade aktualisiert wird, liegt der Anteil der „abgeschlossenen“ Studien bei 27,4%.
Im aktuellen Meldesystem laden die Universitäten direkt ihre zusammengefassten Ergebnisse in das EU Register hoch – als Studiensponsoren sind sie rechtlich dazu verpflichtet und der Prozess liegt komplett in ihrer eigenen Kontrolle. Allerdings können Universitäten nicht direkt den Status ihrer Studien (laufend, abgeschlossen) aktualisieren. Stattdessen müssen sie ihre nationale Zulassungsbehörde darüber informieren, dass eine Studie abgeschlossen ist. Die Behörde aktualisiert dann den Status der Studie im Register. In Ländern mit unerklärlich niedrigen Anteilen an „abgeschlossenen“ Studien, wie die Niederlande, ist es sehr wahrscheinlich, dass die nationalen Behörden eine große Zahl von Registereinträgen nicht geändert haben, obwohl die Studien abgeschlossen waren. Diese Behörden sollten dem positiven Beispiel der britischen MHRA folgen, und systematisch den Status aller klinischen Studien, die in ihrem Land durchgeführt wurden, durchsehen und aktualisieren.
Warum sind britische Universitäten besser?
Im Durchschnitt schneiden die britischen Universitäten deutlich besser ab als die in anderen Ländern. Die schwächste der fünf untersuchten Universitäten im Vereinigten Königreich hat eine Melderate von nur 25%, die zwei Stärksten – University of Oxford und King’s College London – haben bisher schon über 90% der fälligen Studienergebnisse veröffentlicht. Zum Vergleich: von einer Ausnahme abgesehen, hat nicht eine einzige Universität des europäischen Festlands eine höhere Melderate als 20%.
Britische Universitäten haben in Sachen Transparenz eine Führungsposition in Europa eingenommen. Ursache dafür war der Druck des Parlaments, der Forschungsförderer und der Öffentlichkeit.
Druck vom Parlament
Das Science and Technology Committee des britischen Parlaments hat 2018 -2019 eine Untersuchung zu wissenschaftlicher Integrität durchgeführt. Mitglieder des Ausschusses waren schockiert, als sie herausfanden, dass zahlreiche Universitäten regelmäßig gegen die Transparenzregeln verstoßen. Anfang 2019 warnte der Vorsitzende des Ausschusses die britischen Universitäten mit einem Schreiben, dass sie vor den Ausschuss zitiert würden und sich rechtfertigen müssten, wenn sie die fehlenden Studienergebnisse nicht bis Sommer 2019 in das Register einstellten.[4]
Druck von den Forschungsförderern
Die zwei öffentlichen medizinischen Forschungsförderungsorgane im Vereinigten Königreich, das NIHR und der MRC, sowie der private Wellcome Trust haben 2017 die gemeinsame Erklärung der WHO zur Veröffentlichung von Studienergebnissen2 unterzeichnet. Mit ihrer Unterschrift verpflichten sich die Forschungsförderer, die Regeln zur Studienregistrierung und Ergebnismeldung gemäß der WHO Best Practices zu befolgen und zu kontrollieren, ob die geförderten Projekte diese Regeln befolgen. Der MRC hat bereits ein exzellentes Review zu den von ihm geförderten klinischen Studien durchgeführt.[5] In den folgenden Jahren könnten britische Universitäten, die es versäumen ihre Studienergebnisse rechtzeitig in den Registern zu veröffentlichen, von weiteren Förderungen ausgeschlossen werden.
Öffentlicher Druck
Eine von TranspariMED initiierter loser Zusammenschluss von Gruppen, die sich um Integrität in der Gesundheitsversorgung kümmern, darunter Universities Allied for Essential Medicines (UAEM-UK), HealthWatch UK, Transparency International Health und STOPAIDS, hat sich an das Parlament gewendet, die Medien informiert und Druck auf die Universitäten ausgeübt, um eine bessere Meldepraxis für Studienergebnisse zu erreichen.
TranspariMED und UAEM-UK haben zudem mehrere Berichte zur Leistung einzelner britischer Universitäten veröffentlicht.[6] Zeitgleich hat sich die hauptsächlich in Großbritannien aktive AllTrials Kampagne[7] des Problems angenommen, unter anderem mit regelmäßigen E-Mails an ihre über 90.000 Unterstützer. Das EBM Data Lab der University of Oxford hat den EU Trials Tracker konzipiert, von dem die Daten für den vorliegenden Bericht stammen. Das EBM Data Lab arbeitet mit der AllTrials Kampagne zusammen und hat dem Parlamentsausschuss mit den notwendigen Daten zur Veröffentlichungspraxis von klinischen Studien der Universitäten versorgt.
Der gebündelte Druck hatte einen enormen Einfluss auf das Meldeverhalten der britischen Universitäten. Das King’s College London beispielsweise hat innerhalb nur eines halben Jahres seine Melderaten von 18% auf 93% verbessert. Die University of Nottingham, die vom Parlamentsausschuss 2018 wegen ihrer schlechten Leistung angeprangert wurde, hat inzwischen die Ergebniszusammenfassungen zu über 95% der von der Uni durchgeführten Studien veröffentlicht.
Soweit TranspariMED das beurteilen kann, arbeitet momentan jede medizinische Universität im Vereinigten Königreich hart daran, fehlende Studienergebnisse im EU Register hochzuladen und oftmals sogar in anderen Registern, wie das ISRCTN und das US Register Clinicaltrials.gov. Dadurch wird deutlich, dass wo ein Wille ist, auch ein Weg ist – andere Universitäten in Europa können also ebenfalls die Probleme lösen, wenn sie wollen. (Siehe Artikel zur Nottingham University auf S. 10.)
Momentan arbeitet die britische Regierung daran, ein umfassendes nationales Monitoringsystem für klinische Studien einzuführen. Es soll jede einzelne klinische Studie, die auf britischem Boden durchgeführt wird, nachverfolgen, einschließlich kommerzieller und länderübergreifender Studien. Damit soll sichergestellt werden, dass alle Studien registriert und ihre Ergebnisse veröffentlicht werden.
Relevanz für die Praxis
Da Verschweigen von Studienergebnissen ist kein Kavaliersdelikt. Ein Bericht von 2017 von Transparency International und Cochrane zeigt, dass es fehlende Ergebnisberichte von Studien gravierende negative Konsequenzen haben können:[8] Patienten geraten durch falsche Behandlungsentscheidungen in Gefahr, öffentliche Einrichtungen können keine informierten Entscheidungen über den Nutzen von Arzneimitteln treffen, öffentliche Gelder werden verschwendet und der medizinische Fortschritt wird verlangsamt.
Rechtliche Rahmenbedingungen
Eine EU-Verordnung schreibt seit Juli 2014 vor, dass eine Zusammenfassung der Ergebnisse für jede einzelne Studie, die im EU Studienregister EudraCT eingetragen ist, innerhalb von zwölf Monaten (bei pädiatrischen Studien sechs Monate) nach Studienabschluss veröffentlicht werden muss. Das bedeutet, dass alle in diesem Bericht ermittelten klinischen Studien, bei denen eine Zusammenfassung der Ergebnisse fehlt, gegen die Transparenzverordnung der EU verstoßen. Sie wurde eingeführt, um die Interessen der PatientInnen und SteuerzahlerInnen zu schützen.
Verschwendete Forschung
Ungemeldete Studien hemmen den Fortschritt in der Wissenschaft, schaden der öffentlichen Gesundheit und sind daher eine Verschwendung von Forschungsgeldern. In der Vergangenheit haben das Verschweigen der Ergebnisse von klinischen Studien zum Tod unzähliger PatientInnen und Verluste im Wert von Milliarden Euros verursacht.[9] Aus diesem Grund hat die Erklärung von Helsinki das Melden von Ergebnissen jeder klinischen Studie zu einer universeller ethischen Pflicht für alle medizinischen ForscherInnen weltweit erklärt.[10]
Nicht alle Studien, die ihre Ergebnisse nicht im EU Studienregister eingetragen haben, sind komplett unveröffentlicht. Jedoch weist die bestverfügbare Evidenz darauf hin, dass etwa von der Hälfte aller Studien, deren Ergebnisse im EU Register fehlen, auch nicht in Fachzeitschriften veröffentlicht wurden. Dadurch geraten Hunderte von Studien an europäischen Universitäten in Gefahr, eine Verschwendung von Forschungsgeldern zu werden, werden ihre Ergebnisse nicht bald veröffentlicht.
Universitäten müssen dringend ihre klinischen Studien im EU-Register, dem US-Register clinicaltrials.gov und anderen WHO Primärstudienregistern durchsehen, ungemeldete Studien identifizieren und sicherstellen, dass fehlende Eintragungen nachgeholt und die Ergebnisse einer Studie so bald wie möglich nach deren Abschluss veröffentlicht werden.
Global Best Practices
Die WHO Standards schreiben vor, dass die Ergebnisse jeder Interventionsstudie in jedem öffentlichem Register, in dem sie eingetragen sind, zwölf Monate nach Abschluss der Studie veröffentlicht werden. Die WHO hebt hervor, dass die Veröffentlichung von Studienergebnissen in der Fachliteratur kein Ersatz zur Meldung der Ergebnisse in öffentlichen Registern darstellt.
Best Practices, die gemeinsam von Cochrane und Transparency International entwickelt wurden, sehen ebenfalls vor, dass „eine Zusammenfassung der Ergebnisse für alle klinischen Studien in den Registern, in denen sie ursprünglich registriert wurden, innerhalb von zwölf Monaten nach Studienabschluss hochgeladen werden muss.“8 Beide Organisationen machen darauf aufmerksam, dass das nachträgliche Hochladen der Ergebnisse von allen vergangenen Studien in den Registern „die Gesundheitsversorgung und die Entscheidungsfindung von Regierungseinrichtungen zur Ressourcenverteilung verbessern würde, und gleichzeitig würden Milliarden von Dollar für medizinische Forschung davor bewahrt, für immer verloren zu sein.“
Übereinstimmend damit fordert die AllTrials Kampagne, dass „eine Zusammenfassung der Ergebnisse […] dort wo die Studie registriert wurde innerhalb eines Jahres nach Studienabschluss hochgeladen werden sollte.“
Es gibt gute Gründe dafür, dass alle Studienergebnisse in den Registern veröffentlicht werden sollten. Das Hochladen der Ergebnisse in den Registern beschleunigt den medizinischen Fortschritt, denn durch die 12-Monatsfrist können Ergebnisse deutlich schneller geteilt werden. Der Veröffentlichungsprozess in der Fachliteratur ist viel langwieriger.
Das Risiko, dass die Ergebnisse einer Studie nie veröffentlicht werden und eine Verschwendung von Forschung darstellen, wird minimiert. Das kann sonst zum Beispiel passieren, wenn der Studienleiter während des langwierigen Prozesses einer wissenschaftlichen Veröffentlichung stirbt oder seine Stelle wechselt.
Forschung hat ergeben, dass Studienergebnisse, die in Register hochgeladen wurden, üblicherweise ein verständlicheres und genaueres Bild der Ergebnisse, die für PatientInnen relevant sind, geben als wissenschaftliche Publikationen. Studienergebnisse in den Registern sind einfacher aufzufinden und öffentlich zugänglich. Das Melden in Registern vereinfacht es, die Studienergebnisse mit den ursprünglich festgelegten Zielen zu vergleichen. Somit werden schädliche Verletzungen der Sorgfaltspflicht in der Forschung, wie das „stille“ Zurückhalten unvorteilhafter Ergebnisse, Hinzufügen oder Ändern der ursprünglich festgelegten Endpunkte,[11] selektives Berichten von für den Sponsor günstigen Ergebnissen und Praktiken wie HARKing[12] und p-hacking,[13] weniger wahrscheinlich.[14]
Falsche Vorwände
Das International Committee of Medical Journal Editors befürwortet das Hochladen von Studienergebnissen in Studienregistern und betont, dass das nicht als Vorveröffentlichung eines Artikels betrachtet wird. Das bedeutet, dass wissenschaftliche Zeitschriften Artikel akzeptieren, auch wenn die Ergebnisse zuvor im Studienregister veröffentlicht wurden.[15] Da das Melden der Ergebnisse in den Registern üblicherweise schneller ist als eine wissenschaftliche Publikation, ist es nun Best Practice für wissenschaftliche Kommunikation, die Studienergebnisse in Registern zu veröffentlichen, bevor sie in der Fachliteratur erscheinen.
Der vorliegende Text wurde ursprünglich von Till Bruckner verfasst, von Hannah Eger übersetzt und von Jörg Schaaber überarbeitet. c Er unterliegt wie das Original [16] einer Creative Commons BY 3.0 Lizenz.
Artikel aus dem Pharma-Brief 4-5/2019, S.5
Bild window cleaning © Vikramjit Kakati
[1] Die Untersuchung wurde von Till Bruckner (TranspariMED) durchgeführt. Der vorliegende Text ist eine überarbeitete und leicht gekürzte Fassung des englischen Originals.
[2] WHO (2017) International Clinical Trials Registry Platform (ICTRP) Joint statement on public disclosure of results from clinical trials www.who.int/ictrp/results/jointstatement/en
[3] http://eu.trialstracker.net/sponsor/university-of-munster
[4] Bruckner T (2019) UK government promises national strategy to boost clinical trial reporting. 25 Feb. www.transparimed.org/single-post/2019/02/25/UK-government-promises-national-strategy-to-boost-clinical-trial-reporting
[5] MRC (2017) MRC Review of Clinical Trials. https://mrc.ukri.org/research/policies-and-guidance-for-researchers/review-of-clinical-trials
[6] www.transparimed.org/resources
[8] TI (2017) Clinical trials transparency https://docs.wixstatic.com/ugd/01f35d_def0082121a648529220e1d56df4b50a.pdf
[9] Bruckner T and Ellis B (2017) Clinical Trial Transparency https://media.wix.com/ugd/01f35d_0f2955eb88e34c02b82d886c528efeb4.pdf
[10] WMA (2019) Declaration of Helsinki www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects
[11] Altman DG et al. (2017) Harms of outcome switching in reports of randomised trials: CONSORT perspective. BMJ;356, p j396
[12] HARKing = Hypothesizing after the results are known. Neue Hypothesen aufstellen, wenn man die Ergebnisse schon kennt
[13] p-hacking. So lange mit den Daten spielen, bis das statistische Signifkanzniveau (p-Wert) doch noch erreicht wird. Üblicherweise gilt ein p-Wert unter 0,05 als signifikant (das Ergebnis ist dann zu 95% nicht zufällig)
[14] Munafò MR et al. (2017) A manifesto for reproducible science. Nature Human Behaviour; 1, article number 0021 www.nature.com/articles/s41562-016-0021
[15] ICMJE (2019) Clinical Trials www.icmje.org/recommendations/browse/publishing-and-editorial-issues/clinical-trial-registration.html [Zugriff 24.7.2019]
[16] www.bukopharma.de/images/pressemitteilungen/2019/Clinical_Trial_Transparency_EU_Universities_2019.pdf
Kaum Regeln zum Umgang mit Interessenkonflikten
Big Pharma beeinflusst Medizinstudierende – Universitäten schauen weg
Pharmafirmen üben durch Werbung und Sponsoring bereits während des Medizinstudiums Einfluss auf die ÄrztInnen von morgen aus. Eine neue Studie der Studierendenorganisation Universities Allied for Essential Medicines (UAEM) zeigt, dass medizinische Fakultäten in Deutschland kaum etwas unternehmen, um ihre Studierenden vor kommerzieller Beeinflussung zu schützen.
Eine aktuelle Publikation von UAEM macht die Versäumnisse deutscher Universitäten deutlich: Die Studierendenorganisation untersuchte den Umgang mit Interessenkonflikten an 38 medizinischen Fakultäten und bewertete deren institutionalisierte Regeln zum Umgang mit Interessenkonflikten anhand eines Punktesystems. Zur Ermittlung der Daten kontaktierten die AutorInnen die Dekanate der Fakultäten und recherchierten zusätzlich auf deren Webseiten anhand einschlägiger Suchbegriffe. Das Resultat: Lediglich 16 der 38 angefragten Universitäten gaben überhaupt eine Rückmeldung, ob Regelungen zu Interessenkonflikten vorhanden seien. Davon erfüllte jedoch nur eine Regelung der Technischen Universität Dresden die gesetzten Einschlusskriterien. Bei der zusätzlichen webbasierten Suche erfüllte nur die Charité-Universitätsmedizin Berlin die Einschlusskriterien der Studie.
Gerade einmal zwei der 38 medizinischen Fakultäten in Deutschland verfügen demnach über Statuten, anhand derer sich die Studierenden in dem Umgang mit der Pharmaindustrie orientieren können. Doch auch diese Fakultäten kommen bei der qualitativen Bewertung anhand des Punktesystem nicht gut weg: Die TU Dresden erhielt 12 von 26 Punkten, die Charité Berlin 4 von 26.[1]
Firmen machen schon Studierenden Avancen
Dabei wäre es dringend geboten, bereits angehende MedizinerInnen im Umgang mit Interessenkonflikten zu schulen und gegen die Avancen der Industrie entsprechend zu rüsten. Denn die Hersteller versuchen die zukünftigen ÄrztInnen schon früh abzuholen. In einer Umfrage an acht medizinischen Fakultäten in Deutschland fanden Lieb und Koch schon vor mehreren Jahren heraus, dass lediglich 12% der Befragten nie ein Geschenk von der Pharmaindustrie erhalten oder an einer gesponserten Veranstaltung teilgenommen hatten.[2] Einer Studie von Jahnke et al. zufolge, waren 77% der Medizinstudierenden vor Ende ihrer klinischen Ausbildung mindestens einmal mit VerkaufsvertreterInnen eines Pharmakonzerns konfrontiert gewesen. 13% waren sogar außerhalb der Universität direkt kontaktiert worden.[3]
Das Medizinstudium trägt jedoch wenig dazu bei, angehende MedizinerInnen vor solcher Beeinflussung zu schützen: 65% der Studierenden fühlen sich nicht gut auf den Umgang mit der pharmazeutischen Industrie vorbereitet und 90% berichten, dass der Umgang mit PharmavertreterInnen und deren Werbepraktiken nie in einer Vorlesung thematisiert wurde.[3]
Interessenkonflikte kommen in der Lehre nicht vor
Es ist also schon seit mehreren Jahren bekannt, dass hier großer Bedarf besteht. Schließlich sind Interessenkonflikte gerade im Gesundheitswesen besonders häufig. Denn das Interesse der PatientInnenpflege kollidiert nicht selten mit dem Bestreben der Industrie, Arzneimittel oder Medizinprodukte gewinnbringend zu verkaufen. Gerade ÄrztInnen sind mit massivem Marketing der Hersteller konfrontiert – die Bandbreite der Beeinflussungsstrategien reicht von kleinen Geschenken, die das Verschreiben bestimmter Arzneimittel versüßen über das Sponsoring von Fortbildungen und fürstlich entlohnten Anwendungsbeobachtungen bis hin zur Praxis-Software, die mit Werbeanzeigen bespickt ist.[4] Der kritische Blick auf solche Werbestrategien tut Not. Denn nur, wer früh lernt, Beeinflussung zu durchschauen und deren Folgen kennt, kann sich auch wirksam davor schützen. (MB/CJ)
Artikel aus dem Pharma-Brief 7-8/2019, S.2
[1] Grabitz P et al. (2019) Conflict of Interest Policies at German medical schools – A long way to go. www.biorxiv.org/content/10.1101/809723v1 [Zugriff 22.10.2019]
[2] Lieb K and Koch C (2013) Medical Students’ Attitudes to and Contact With the Pharmaceutical Industry. Deutsches Ärzteblatt International; 110, p 586 http://dx.doi.org/10.3238/arztebl.2013.0584
[3] Jahnke K et al. (2014) Exposition und Einstellungen deutscher Medizinstudierender zu Pharmawerbeaktivitäten: Eine Querschnittsstudie. GMS Zeitschrift für Medizinische Ausbildung; 31, S. 10 http://dx.doi.org/10.3205/zma000924
[4] Berndt C und Grill M (2019) Medizinische Fakultäten ignorieren Interessenkonflikt. Süddeutsche Zeitung. www.sueddeutsche.de/wissen/pharmaindustrie-universitaeten-interessenkonflikte-1.4644884 [Zugriff 22.10.2019]
Interessenkonflikte und der Schutz der öffentlichen Gesundheit
Interview mit Judith Richter
Judith Richter arbeitet seit vielen Jahren zum Thema Interessenkonflikte mit Schwerpunkt auf internationale Organisationen. Wir haben sie befragt, wie sich die Situation in den letzten Jahrzehnten verändert hat, welche negativen Folgen das hat und was zu einer Verbesserung der Lage notwendig wäre.
Ich habe gehört, dass du in den letzten Jahren, versucht hast, das Konzept der Interessenkonflikte auf zahlreichen Konferenzen und in Schulungen zu erklären. Wie und wann begann dein Interesse an diesem Thema?
Als Person, die im Gesundheitsbereich arbeitet, bin ich schon lange an Interessenkonflikten interessiert gewesen, auch wenn ich damals diesen Begriff noch nicht benutzte. Als ich zum Beispiel in den siebziger Jahren Vizepräsidentin des Schweizerischen Pharmaziestudentenverbandes (ASEP) war, verfochten wir die Ansicht, dass Apotheker es ablehnen sollten, ihre Schaufenster von Pharmafirmen dekorieren zu lassen. Wir befürchteten, die KundInnen könnten Apotheken als Outlet von Pharmafirmen ansehen und nicht als Orte, die eine unabhängige Gesundheitsberatung anbieten.
In den 1990er Jahren bat mich IBFAN-Europe (International Baby Food Action Network)[1] zu seinen internen Diskussionen über Interessenkonflikte beizutragen: Wie könnten IBFAN-Mitglieder zum Beispiel am besten thematisieren, dass die Hersteller von Muttermilchersatzprodukten sowohl Kinderarztverbände als auch deren Weiterbildungen sponserten? Wir diskutierten auch die möglichen Interessenkonflikte durch finanzielle Verbindungen von StillberaterInnen mit Herstellern von Milchpumpen.
Damals wurde ich auch von Health Action International Europe eingeladen, meine Bedenken bezüglich des Sponsorings durch Pharmaunternehmen und reiche Unternehmensphilanthropen wie Bill Gates darzulegen.[2]
Das Thema Interessenkonflikte wurde also schon damals breit diskutiert?
In der Tat. Und etliche ForscherInnen im Bereich Interessenkonflikte (Conflict of Interest, CoI) betonen, dass der Aufstieg des neoliberalen Wirtschaftsmodells die Anzahl bereits bestehender Interessenkonflikte noch vergrößert und neue Typen geschaffen hat.
Meine Arbeit als Soziologin zu adäquatem und wirksamem Schutz öffentlicher Interessen – einschließlich der Regulierung von Interessenkonflikten – begann 2002. Damals hatte ich gerade eine längere Beratertätigkeit für UNICEF über die Möglichkeiten effektiver Regulierung der Marketingmethoden transnationaler Säuglings- und Kindernahrungskonzerne beendet.[3] Durch diese Arbeit wurde ich auf die immer engeren Verbindungen von UN-Organisationen mit transnationalen Firmen aufmerksam. Sie riskierten dadurch ihr eigentliches Mandat zu vernachlässigten, die Aktivitäten eben dieser Konzerne durch internationale Regulierungen zu kontrollieren.
Mein Anliegen – und auch zum Beispiel das der finnischen Forscherin Eeva Ollila[4] – war damals, auf die vielfältigen Risiken aufmerksam zu machen, die sogenannte Globale Öffentlich-Private Partnerschaften für Gesundheit (GHPPP) und Multi-Stakeholder Initiativen (MSIs) mit sich bringen: sie untergraben die Fähigkeit öffentlicher Institutionen, im öffentlichen Interesse zu handeln.
Die finnische Regierung bat mich, zu untersuchen, welche Möglichkeiten es gebe, dies abzuwenden. Ich fand heraus, dass die damalige Generaldirektorin der WHO, Dr. Brundtland, den WHO Mitgliedsstaaten versichert hatte, die WHO werde Richtlinien und Trainingskurse entwickeln, um Interessenkonflikte zu erkennen und zu vermeiden. Als ich jedoch Mitarbeiter der WHO dazu interviewte, teilten sie mir mit, dass dieses Projekt gestoppt worden war. Ihnen wurde damals eingeimpft, sie sollten transnationale Firmen im Gesundheitsbereich lieber als ‘Partner’ ansehen und nicht als profitorientierte Akteure. Das Achten auf Interessenkonflikte wurde in diesem Modell als Hindernis gesehen, auf ‚flexiblere Art und Weise‘ zu arbeiten. Ein leitender juristischer Funktionär der WHO teilte mir mit, dass die existierenden CoI Definitionen als ‘zu einschränkend’ wahrgenommen würden. Mitarbeiter auf unterer Ebene befürchteten dagegen, dass sie nicht in der Lage sein würden, problematische Vorschläge von Großunternehmen und reichen Sponsoren abzuwehren.[5]
Das motivierte mich, existierende Interessenkonflikts-Theorien und Richtlinien zu untersuchen. Ich hoffte, das könnte helfen, eventuelle Missverständnisse zu klären, die die WHO davon abhielten, ihre Beziehungen mit Firmen und Unternehmensphilanthropen angemessen zu regulieren.
Etwas später bat mich das Genfer Regionalbüro von IBFAN, zum Paragraph 35 der WHO/UNICEF Globalen Strategie zur Ernährung von Säuglingen und Kleinkindern zu arbeiten.[6] Dieser Artikel besagt, dass „alle Partner zusammenarbeiten sollten“ – auch indem sie Allianzen und „Partnerschaften“ formen – „im Einklang mit akzeptierten Prinzipien zur Vermeidung von Interessenkonflikten.“ Jedoch waren diese Prinzipien nirgendwo präzisiert. Ich untersuchte, wie man hier Abhilfe schaffen könnte und veröffentlichte “Conflicts of Interest and Policy Implementation – reflections from the fields of health and infant feeding“.[7]
Kannst du eine brauchbare Definition von Interessenkonflikten geben?
In oben genannter Publikation wies ich im Wesentlichen auf drei Definitionen hin: Eine wurde entwickelt für den öffentlichen Dienst in den Ländern der Organisation für Wirtschaftliche Zusammenarbeit und Entwicklung[8] (OECD) und zwei Definitionen stammen aus dem Bereich der Gesundheit.
Die erste Definition, wurde entwickelt von dem politischen Philosophen Professor Dennis F. Thompson.[9] Ich fand seine Definition von Interessenkonflikten als Konflikten zwischen primären und sekundären Interessen nützlich, um zu erklären, warum man über Konflikte von „Interessen“ spricht. Diese Definition hat sich mit geringfügigen Änderungen seitdem weit verbreitet durch den Bericht des Kommitees des US Institute of Medicine (IoM) zu Interessenkonflikten in der medizinischen Forschung, Ausbildung und Praxis.[10] „Interessenkonflikte sind definiert als Gegebenheiten, die ein Risiko dafür schaffen, dass professionelles Urteilsvermögen oder Handeln, welches sich auf ein primäres Interesse beziehen, durch ein sekundäres Interesse unangemessen beieinflusst wird“ [11]
Wie du weisst, haben kritische deutsche ÄrztInnen die Thompson-IoM Definition in ihrer Arbeit zur besseren Identifizierung von Interessenkonflikten im medizinischen Bereich übernommen und viele nützliche Ratschläge weiterentwickelt. [11]
Die andere Definition, die ich damals fand, wurde von dem Rechtsprofessor Marc Rodwin formuliert. Sein Buch „Medicines, Money & Morals: Physicians‘ Conflicts of Interest“ [12] wurde 1993 veröffentlicht, im gleichen Jahr wie der vielzitierte Artikel von Thompson. Rodwin fasste seine Konzeption kürzlich nochmals wie folgt zusammen: „Ein Interessenkonflikt existiert, wo ein Individuum eine Verpflichtung hat, einer Partei zu dienen oder eine Rolle zu spielen, und das Individuum andererseits: 1) Anreize oder 2) widersprüchliche Loyalitäten hat, die das Individuum ermutigen, in einer Art und Weise zu handeln, mit der es seine Verpflichtungen bricht.“ [13]
Wie mir Professor Rodwin erklärte, folge er damit der Begriffsauffassung, die im amerikanischen Recht seit dem 20. Jahrhundert üblich ist. Diese rechtliche Definition ist etwas komplexer, das stimmt. Das US Institute of Medicine hatte die Thompson-IoM Definition als die „zweckmäßigste“ hervorgehoben. Ich hatte nie die Gelegenheit zu fragen, warum die IoM Komission anscheinend die Konzeption von Professor Rodwin nicht in ihrer Arbeit berücksichtigt hat. Ich empfand Rodwins Zusammenfassungen der rechtlichen Definitionen als überaus hilfreich, um das Wesen von Interessenkonflikten besser zu verstehen und vor allem, Möglichkeiten ihrer effektiven Vermeidung und Regulierung aufzuzeigen.
Ich plädiere heute mehr als je dafür, die Regulierung von Interessenkoflikten auf eine solche traditionell-rechtliche Definition zu gründen. Der Hauptgrund ist, dass sie die Verpflichtungen/Pflichten als Schlüsselreferenz klar hervorhebt. In einem neueren Artikel drückte Professor Rodwin seine Beunruhigung darüber aus, dass die Thompson-IoM Definition Probleme schaffe, mit ihrer Beschreibung eines Interessenkonfliktes als einem Konflikt zwischen “primären“ und “sekundären“ Interessen und nicht als einem„Konflikt zwischen Verpflichtungen und Interessen“.[14] In der Tat, Verpflichtungen beziehen sich auf eine völlig andere Ebene als „sekundäre“ finanzielle Interessen.
Um Rodwin’s rechtliche Definition anwenden zu können, müssen wir die rechtlichen und grundlegenden ethischen Pflichten der Individuen präzisieren. So können wir am besten sehen, ob ein Einzelner finanzielle Verbindungen oder geteilte Loyalitäten hat, die mit diesen Pflichten in Konflikt stehen.[15]
Grundlegende ethische Prinzipien in Gesundheitsberufen sind z.B. das uralte Diktum: „Als erstes füge keinen Schaden zu“ und auch die Pflicht, verständliche Information und Rat zu geben, die voll und ganz im Interesse der Gesundheitssubjekte sind.
Mit diesem umfassenderen Konzept wäre das derzeitige Chaos in der globalen Gesundheitspolitik vielleicht vermieden worden. Zum Beispiel die Tatsache, dass es heute ein Hybrid zwischen öffentlichen und privaten Akteuren, die sogenannte Scaling-Up Nutrition (SUN) „Multi-stakeholder Plattform“ oder „Bewegung“ gibt, die ursprünglich als PP PPP – principled, peoples public-private partnership – lanciert wurde.[16] Hier werden „gemeinsame“ Belange zum Referenzpunkt von Interessenkonflikt-Regulierung erklärt und diese fragwürdige Interpretation in den Ländern verbreitet, die zu SUN-countries erklärt wurden.[17]
Es geht also um die Notwendigkeit, grundlegende rechtliche und ethische Pflichten für einzelne Angehörige der Gesundheitsberufe auszubuchstabieren? Wie würde das aussehen für Leute, die bei internationalen Organisationen arbeiten, bei der UN oder der WHO?
Ich habe bisher nur ein erstes Beispiel gegeben für weithin anerkannte und richtungsweisende ethische Prinzipien für Gesundheitspersonal. Für alle, die im internationalen Gesundheitsbereich tätig sind, gilt natürlich der Grundsatz, der als erster in der Verfassung der WHO verankert ist: es geht um den Schutz und die Förderung unser aller Menschenrecht auf Gesundheit.
Manche Personenkreise brauchen noch einen besonderen Schutz. Für diejenigen, die sich mit Kinderernährung befassen, im politischen Bereich, aber auch für KinderärztInnen und Stillberaterinnen, gelten daher zusätzliche Verpflichtungen, die sich aus den Verfassungen der UN und der WHO und aus Menschenrechtsdokumenten und relevanten Kodices und ergeben.
Die Kinderrechtskonvention der UN (CRC) fordert z.B. alle gesellschaftlichen Akteure dazu auf, immer „im besten Interesse des Kindes“ zu handeln. Sie schreibt auch „das Recht des Kindes auf einen bestmöglichen Gesundheitszustand“ fest oder die Verpflichtung „sicherzustellen, dass alle Bereiche der Gesellschaft, insbesondere Eltern […] informiert und unterstützt werden im Hinblick auf Grundwissen über Kindergesundheit und -ernährung, [und] die Vorteile des Stillens.“ (Art. 24.1 und 24.2e).[18]
Gibt es andere Gründe, eine rechtliche Definition zu bevorzugen?
Ein zweiter Grund ist, dass nicht nur Professor Rodwin, sondern inzwischen auch die Rechtsprofessorin Anne Peters empfiehlt, Loyalitäten in die Konzeptualisierung von CoI einzubeziehen. Das ist eine ihrer Schlussfolgerungen aus theoretischen Überlegungen zum Thema Interessenkonflikte in „Global Governance“.[19] Die Thompson-IoM Definition kann dazu führen, Probleme zu übersehen, die durch geteilte oder sich widersprechende Loyalitäten entstehen.
Finanzielle Interessenkonflikte sind relativ einfach zu verstehen. Sie werden durch alle möglichen Arten von Anreizen geschaffen. Die Forschung aus vielen Berufsfeldern hat gezeigt, dass finanzielle Anreize – oder Beziehungen – uns dazu verleiten können, wissentlich oder unbeabsichtigt auf eine Art zu handeln, die unsere Verpflichtungen verletzt gegenüber denjenigen, die von unserem Urteil abhängen.
Definitionen von Interessenkonflikten, die die Frage von Loyalitäten einschließen, sind etwas komplizierter. Aber sie beschreiben genauer, wie zum Beispiel Gesundheitsfachkräfte ihre Loyalität gegenüber der Person, der sie zu dienen haben, aufspalten, weil sie in potenziell sich widersprechenden Rollen stecken.
Ein viel zitiertes Beispiel ist der Rollenkonflikt von Ärzten, die als Forscher an einem neuen Arzneimittel arbeiten, während sie sich gleichzeitig um das kranke Forschungssubjekt kümmern. Auch im öffentlichen Gesundheitsbereich übernehmen Gesundheitsfachkräfte oder Behördenvertreter oft sich widersprechende Rollen. Seit das Partnerschaftsmodell sich im internationalen Gesundheitsbereich verbreitet hat, ist es nicht unüblich, dass ein und dieselbe Person Fundraising betreibt, und gleichzeitig Hauptakteur bei der Ausarbeitung von Richtlinien für die Beziehung zwischen öffentlichen Institutionen & privaten Geldgebern ist – und eventuell auch noch eingeladen wird, die politische Debatte zu beeinflussen. Ich frage mich oft, welche Folgen das bisher schon hatte.
Wenn Loyalitätsprobleme gezielter angesprochen würden, könnte man sagen, dass viele UN-Mitarbeiter in den vergangenen 20 Jahren in eine Position gespaltener Loyalität gedrängt wurden. Das Modell hinter den globalen PPPs oder „Multi-Stakeholder Partnerschaften“ (MSPs) oder „Plattformen“ fordert von ihnen, im Geist des Vertrauens“ ( „spirit of trust“ oder sogar nach einem für alle Akteure verbindlichen „principle of trust“) zu handeln und „Win-Win-Situationen“ im Interesse beider Seiten zu sichern.
Das Verständnis, dass es die Aufgabe von Amtsträgern, UN FunktionärInnen und GesundheitsexpertInnen ist, zu gewährleisten, dass der Umgang mit kommerziellen Akteuren ganz im Interesse derjenigen ist, denen gegenüber sie eine Treuepflicht haben, wurde allmählich untergraben. Auch der Grundsatz, einen gebührenden Abstand (arms-length) zwischen öffentlichen und kommerziellen Akteuren einzuhalten, ist im Zeitalter des „Verpartnerns“ verloren gegangen – ebenso die Einsicht, dass solche Interaktionen Wachsamkeit (vigilance) und nicht blindes Vertrauen erfordern.
Das hört sich alles ein bisschen kompliziert an. Gibt es eine einfachere Art, die Botschaft näher zu bringen?
Seit IBFAN mich zum ersten Mal bat, Interessenkonflikte in öffentlich-privaten „Partnerschaften“ und „Allianzen“ zu erklären, begann ich populäre Sprüche zu sammeln. Das IBFAN-Netzwerk hat Mitglieder in der ganzen Welt und so bekam ich Beispiele in vielen Sprachen, die alle zur Bebilderung der Problematik benutzt werden können: Zum Beispiel, “wes Brot ich ess, des Lied ich sing“ oder “du beißt nicht die Hand, die dich füttert“.
In Deutschland sagen wir auch: „Kleine Geschenke erhalten die Freundschaft.“ Gemeinhin ist es also bekannt, dass auch kleine Gaben ein Gefühl der Verpflichtung hinterlassen. Die Forschung hat in der Tat gezeigt, dass wir gewöhnlich das Ausmaß unterschätzen, in dem sogar geringfügige finanzielle Zuwendungen und Geschenke unsere Urteile im Interesse derjenigen verschieben, die sie machen. Firmen bauen auf das, was die Theorie des Interessenkonflikts den ‚blinden Fleck der Voreingenommenheit’ (bias blind spot) nennt.
Vor kurzem präsentierte ich auf einer IBFAN-GIFA Pressekonferenz einfache Bilder zu Interessenkonflikten in der Global Health Governance, die Interessierte im Internet ansehen können.[20] Ich ermutige die Leserinnen und Leser des Pharma-Briefes, sich auch den Beitrag von Professor David Klemperer auf dieser Pressekonferenz anzusehen. Er zitiert Schulungsmaterial von Pharmafirmen, das Pharmavertreter lehrt, bei Ärzten freundschaftliche Gefühle zu wecken, indem sie sie z.B. zum Essen einladen, dabei aber selbst nie zu vergessen, dass diese Beziehung rein kommerzieller Natur ist.
Schaut euch auch die Abbildung einer Person mit einem Spalt im Kopf an. Sie illustriert sehr gut die Tatsache, dass der Interessenkonflikt letztlich in unserem Kopf stattfindet. Das Bild macht deutlich, dass Leute von außen nicht sehen können, was in unseren Köpfen passiert, ob und in welchem Grad wir durch gewisse finanzielle Beziehungen oder gespaltene Loyalitäten beeinflusst werden.
Und das ist der Grund, warum gute Regelwerke zu Interessenkonflikten versuchen, Interessenkonflikte zu identifizieren und bestmöglich zu vermeiden, ehe Schäden verursacht werden.
Professorin Anne Peters betont, ein effektives Konzept darf die Definition nicht ausufern lassen. Ein Interessenkonflikt sei letztlich ein Konflikt im Inneren von Menschen und Institutionen, die öffentliche Interessen vertreten und nicht zwischen ihnen und kommerziellen Akteuren. Sie weist darauf hin, dass manche Theoretiker Konflikte zwischen Akteuren als widersprüchliche, konfligierende Interessen bezeichnen. Im Englischen wäre das eine Unterscheidung zwischen Conflicts of Interest (CoIs) and Conflicting Interests.
Durch diese Unterscheidung würde wieder klar, dass wir eine Debatte über zwei verschiedene Dinge führen müssten: Auf der einen Seite über die vernachlässigten Interessenkonflikte in der internationalen Arena; auf der anderen Seite darüber, dass es einen fundamentalen Unterschied gibt zwischen den Fiduciary duties – den Treuepflichen – von öffentlichen Institutionen und denen von Großunternehmen, die ihren Aktionären gegenüber die Verpflichtung haben, den Profit zu mehren. Beide Problematiken werden im neoliberalen Partnerschaftsmodell bewusst verdrängt und Kritiker mundtot gemacht.
Kannst du mir erklären, warum sich alle, die sich mit internationaler Gesundheitspolitik beschäftigen, Interessenkonflikte in den Fokus nehmen sollten?
Weil die bestmögliche Vermeidung von CoIs ein Grundpfeiler professioneller Integrität ist. Ich möchte dazu ermutigen, sich Fragen anzuschauen, die in Diskussionen um Interessenkonflikte aufkamen. Zum Beispiel hat die Forschung gezeigt, dass Ärzte, die finanzielle Zuwendungen von Pharmafirmen erhalten, dazu tendieren, zwei Dinge zu tun: Vorzugsweise das Arzneimittel der sponsernden Firma zu verschreiben, selbst wenn es nicht das Beste für eine bestimmte Krankheit ist – und zu viel zu verschreiben. Das bedeutet, sie tendieren dazu, mehr Tabletten zu verordnen als die Leute brauchen.
Ein anderes wichtiges Beispiel ist die Debatte um Muttermilchersatzprodukte. Darauf kann man sich bis heute berufen. Die WHO konnte Anfang der 1980-er Jahre noch mit Hilfe von UNICEF einen internationen Kodex für Marketingmethoden verabschieden.
Danach haben diese Firmen mit Hilfe ihrer politischen PR-Experten eine Strategie entwickelt, die andere Firmen im Gesundheitsbereich kopierten und immer weiterentwickelten, um die Verabschiedung weiterer spezifischer internationaler Verhaltenskodizes zu verhindern. Einzige Ausnahme ist die Tabak-Konvention.
Interessant ist wie in der internationalen Säuglingsnahrungsdebatte weitere relevante Resolutionen der Weltgesundheitsversammlung gezielt Interessenkonflikte ansprachen. Eine Zusammenfassung machte unlängst der UNICEF-Jurist David Clark. Diese Zusammenfassung könnte auch die Debatte von Interessenkonflikten bezüglich anderer „commerciogenic diseases“ – von kommerziellen Praktiken erzeugten Krankheiten – beleben.[21]
Wie kann man am besten über Interessenkonflikte sprechen?
Das ist nicht so einfach. Wenn ich das Thema anspreche, ist die Reaktion oft „jetzt kommt die schon wieder mit ihrer alten Leier.“
Es geht leider nicht nur um Reaktionen von PolitikerInnen, FunktionärInnen und WissenschaftlerInnen, die Gelder von der Industrie oder den großen Venture-Philanthropy Stiftungen von Gates und Ted Turner erhoffen. Viele GesundheitsaktivistInnen scheinen die Identifizierung und effektive Regulierung von Interessenkonflikten für eine Detailarbeit zu halten, die ihre schon überstrapazierten Kräfte zu sehr in Anspruch nimmt.
Ich habe auch lange gedacht, es sei zwar wichtig, immer wieder auf krasse Interessenkonflikte aufmerksam zu machen und das Bewusstsein für die allgemeine Problematik aufrechtzuerhalten, aber es sei am besten, die konkrete Ausformulierung von Regulierungs-Werken Spezialisten zu überlassen. Inzwischen musste ich miterleben, wie die WHO bei der Ausarbeitung ihres Frameworks for Interaction with non-State Actors (FENSA) und bei dem Modellvorschlag, wie mit Interessenkonflikten in nationalen Ernährungsmitteldebatten (conflict of interest tool) umgegangen werden soll, das Interessenkonflikts-Konzept bewusst uminterpretiert hat und es, trotz aller Kritik, als Konflikt zwischen Akteuren definiert.[22] Ratschläge von Aktionsgruppen und ExpertInnen, die die Probleme der WHO Konzeption kritisierten, wurden dabei bewusst ignoriert.[23],[24]
Ich habe heute dazu noch die bange Frage: Gibt es eigentlich noch genügend Spezialisten zu Interessenkonflikten, die den theoretischen und praktischen Nachholbedarf in der Behandlung der Fragen leisten können oder wollen? Wie weit beinträchtigt der Druck auf akademische Einrichtungen, Drittmittel einzuwerben, ihre Fähigkeit das neoliberale Modell und damit zusammenhängende Fragestellungen zu untersuchen und kritisieren?
Dennoch finde ich, dass es wichtig ist, nicht aufzugeben. Menschen die im Gesundheitsbereich arbeiten, ob als ÄrztInnen oder Gesundheitspersonal, ob als PolitikerInnen, Beamte oder AktivistInnen, sollten daran erinnert werden, dass die Regulierung von Interessenkonflikten einen unerlässlichen Schutz darstellt, ausschließlich im besten Interesse von denen arbeiten zu können, die ihrem Urteil vertrauen können müssen: den Patientinnen und Patienten. Letztendlich sind alle Menschen auf ein funktionierendes, bezahlbares Gesundheitssystem angewiesen.
Wir können heute nicht auf die WHO hoffen, die Probleme anzugehen?
Ja, leider. Die WHO ist, nachdem sie das Thema lange vernachlässigt hat, zur aktiven Umdefininition von Interessenkonflikten übergegangen.
Es geht nun darum, zu verhindern, dass nationale und berufständische Regulierungen zu Interessenkonflikten ebenfalls untergraben werden. Das ist besonders zu befürchten, wenn diese Akteure in Multi-Stakeholder Partnerschaften eingebunden werden.
Das muss nicht heißen, dass nun alle BürgerInnen ExpertInnen in Sachen Interessenkonflikte werden müssen. Aber es gibt ein Werkzeug aus diesem Bereich, dass jedeR von uns verwenden kann. Es heißt „reasonable person test“ – ein Test durch eine vernünftige Person, nachdem sie alle relevanten Informationen erhalten hat. Als Grundlage könnten die obengenannten OECD Leitlinien über Interessenkonflikte im Öffentlichen Dienst8 dienen, die fordern, dass öffentliche Einrichtungen gegenüber der Öffentlichkeit rechenschaftspflichtig sind (public scrutiny). Sonst gehe das Vertrauen in diese Institutionen verloren.
Dies ist eines der Schlüsselprinzipien im Umgang mit Interessenkonflikten im öffentlichem Bereich. Und da sehe ich einen Ansatzpunkt, wie jeder von uns zur Vermeidung und besseren Regulierung von Interessenkonflikten beitragen kann. Die Theorie des Interessenkonflikts besagt, dass jede Situation, die Gesundheitsfachleute oder die besorgte Öffentlichkeit als Interessenkonflikt wahrnehmen, untersucht werden muss und damit verbundene Fragen geklärt werden müssen.
Stellt z.B. eine Liste all der Situationen auf, die ihr als Interessenkonflikt wahrnehmt. Das kann helfen zu klären, welche Probleme Interessenkonflikte im rechtlichen Sinne sind, und welche andere Fragen eventuell noch angesprochen werden müssen, auch wenn sie nicht unter CoIs im engeren Sinne fallen. Dieses anerkannte OECD Prinzip könnte der derzeitigen Tendenz entgegenwirken, Menschen und Gruppen, die Interessenkonflikte oder konfligierende Interessen ansprechen, aktiv aus der Debatte auszuschließen oder ihnen die Gelder zu streichen.
Viele Angehörige der Gesundheitsberufe und öffentlich Bedienstete weisen heute darauf hin, dass es für sie schwierig ist, Interessenkonflikte bei ihrer Tätigkeit zu vermeiden, weil ihre Einrichtung in einer engen Beziehung zu kommerziellen Akteuren steht. Was könnte man dagegen machen?
Einige TheoretikerInnen behandeln dieses Problem unter der Bezeichnung „institutioneller Interessenkonflikt“,10 andere innerhalb des weiteren Rahmens „institutioneller Korruption“ (die sich von Korruption im engeren Sinne unterscheidet).[25],[26]
Es ist unfair und unrealistisch, zu erwarten, dass Individuen Interessenkonflikte komplett vermeiden können, so lange nichts gegen die Ursachen unternommen wird, die dafür sorgen, dass solche Konflikte exponenziell zunehmen. Es ist höchste Zeit, an die Politik heranzutreten, um zu einer wirksamen Regelung von Interessenkonflikten im Bereich der internationalen Gesundheitspolitik zu kommen..
Die wichtigste Ursache für die Zunahme von Interessenkonflikten in der internationalen Gesundheitsarena ist die Hegemonie des Public-Private-Partnerschafts-Modells. Es ist ein Teil der neoliberalen Umstrukturierung unserer Gedankenwelt und Institutionen, die seit Ende der 1980er Jahre weltweit stattgefunden hat. Eine breitere öffentliche Debatte über Interessenkonflikte kann weitere Probleme in diesem Zusammenhang ansprechen. Sie könnte Forderungen nach lange vernachlässigten Instrumenten wie „cooling off periods“ für öffentlich Bedienstete, bevor sie in den Privatsektor wechseln und umgekehrt, dem Schutz von Whistle-blowers und dem Zugang zu wichtigen Informationen im Sinne des amerikanischen Freedom of Information Acts neuen Aufwind verleihen.
Eine solche Debatte würde auch die Absurdität und Gefahr der Idee enthüllen, Großfirmen zu „Richtern in eigener Sache“ zu machen, das heißt, sie z.B. als Partner in die Regulierung ihrer eigenen problematischen Geschäfts- und politischen Praktiken einzubinden – eine Praxis, die sicher entscheidend dazu beigetragen hat, eine wirksame internationale Regulierung der Vermarktung dickmachender Produkte seit 2004 zu verschleppen.
Das Interview führten Claudia Jenkes und Jörg Schaaber.
Artikel aus dem Pharma-Brief 9/2019, S.2
Bild © Lida Lhotski
[2] Richter J (1999) Sponsorship as corporate engineering of consent strategy. In: The ties that bind? Weighing the risks and benefits of pharmaceutical industry sponsorship. Amsterdam: Health Action International (HAI Europe)
[3] Richter J (2001) Holding corporations accountable: Corporate conduct, international codes, and citizen action. London and New York: Zed Books. Für Briefing paper, basierend auf Buch www.thecornerhouse.org.uk/sites/thecornerhouse.org.uk/files/26codes.pdf
[4] Ollila E (2003). Global-health related public-private partnerships and the United Nations, Globalism and Social Policy Programme (GASPP), University of Sheffield., 8 pp. http://praha.vupsv.cz/fulltext/ul_303_2.pdf
[5] Richter J (2004) Public-private partnerships and international health policy making: How can public interests be safeguarded? Helsinki: Ministry for Foreign Affairs of Finland, Development Policy Information Unit www.webcitation.org/query.php?=http://global.finland.fi/julkai/pdf/public_private2004.pdf&refdoi=10.1186/1744-8603-1-6 Kurzfassung Public-private partnerships and Health for All How can WHO safeguard public interests? siehe www.aaci-india.org/Resources/Public-Private-Partnerships-and-Health-for-All.pdf
[6] WHO/UNICEF (2003) Global strategy for infant and young child feeding. Geneva, World Health Organization www.who.int/maternal_child_adolescent/documents/9241562218/en/ , publications
[7] Richter J (2005) Conflicts of interest and policy implementation: reflections from the fields of health and infant feeding. Geneva, IBFAN-GIFA, 2nd ed. www.aaci-india.org/Resources/Conflicts-of-Interest-and-Policy-Implementation-judith-ritcher.pdf
[8] OECD (2003) OECD Guidelines for Managing Conflict of Interest in the Public Service in OECD (2005) Managing Conflict of Interest in the Public Sector. Paris: OECD, p 95-110 www.oecd.org/gov/ethics/managing-conflict-of-interest-in-the-public-sector-9789264018242-en.htm
[9] Thompson, DF (1993) Understanding Financial Conflicts of Interest. N Engl J Med 329, p 573 http://med.stanford.edu/content/dam/sm/bioethics/resources-secure/Thompson2006NEJM.pdf
[10] Lo B and Field MJ (editors) (2009) Institute of Medicine (US) Committee on Conflict of Interest in Medical Research, Education and Practice. Conflict of interest in medical research, education and practice. Washington DC, National Academics Press. www.ncbi.nlm.nih.gov/books/N
[11] Lieb et al. (2018) Interessenkonflikte, Korruption und Compliance im Gesundheitswesen. Berlin: Medizinisch Wissenschaftliche Verlagsgesellschaft.
[12] Rodwin MA (1993) Medicines, Money & Morals: Physicians‘ Conflicts of Interest. Oxford: Oxford University Press
[13] Rodwin MA (2017) Attempts to redefine conflicts of interest. Legal Studies Research Paper Series. Research Paper, Suffolk University Law School. 7 December https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3084307
[14] Rodwin MA (2017) Attempts to redefine conflicts of interest. Legal Studies Research Paper Series. Research Paper, Suffolk University Law School. 7 December https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3084307
[15] Beispiel einer Checkliste für Interessenkonflikte: Rodwin M (2019) Conflict of Interest in the Pharmaceutical Sector: A Guide to Public Management. Legal Studies Research Paper Series(Research Paper 19-3) https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3317603
[16] Lhotska L et al. (2012) Conflicts of Interest and Human Rights-Based Policy Making: the Case of Mater-nal, Infant, and Young Children’s Health and Nutrition, Right to Food and Nutrition Watch, Issue 7, p 31-36 www.righttofoodandnutrition.org/files/R_t_F_a_N_Watch_2012_eng.pdf Zusammenfassung unter www.fian.org/fileadmin/media/publications_2015/FIAN_Right_to_Food_Journal_Vol_7_No._1.pdf p 8
[17] Richter J (2015) Conflicts of interest and global health and nutrition governance - The illusion of robust principles. BMJ, RR, 12 February. www.bmj.com/content/349/bmj.g5457/rr
[18] UNICEF (1989/90) United Nations Convention for the Rights of the Child (CRC) www.unicef.org/child-rights-convention/convention-text
[19] Peters A (2012) Conflict of interest as a cross-cutting problem of governance & Conclusion. In: Peters & Handschin. Conflicts of interest in global, public and corporate governance. Cambridge & New York: Cambridge University Press: S. 3-38 & 357-421
[20] IBFAN-GIFA (2018) Health governance in the public interest? WHO redefines conflicts of interest and risks undermining public health mandates. Press Conference, Geneva, Geneva Press Club/Club Suisse de la Presse. www.gifa.org/press-conference-health-governance-in-the-public-interest-who-redefines-conflicts-of-interest-and-risks-undermining-public-health-mandates (hier finden sich auch ausführlichere Powerpoint-Präsentationen)
[21] Clark D (2017) Avoiding Conflict of Interest in the in the field of Infant and Young Child Feeding: better late than never. World Nutrition; 8
[22] Richter J (2015) Time to debate WHO’s understanding of conflicts of interest. BMJ RR (22 October) www.bmj.com/content/348/bmj.g3351/rr
[23] Lhotska L and Gupta A (2016) Whose health? The crucial negotiations for the World Health Organization’s future. APPS Policy Forum. www.policyforum.net/whose-health
[24] Richter J (2017) Comments on Draft Approach for the prevention and management of conflicts of interest in the policy development and implementation of nutrition programmes at country level. www.who.int/nutrition/consultation-doi/judith_richter.pdf
[25] JLME Special Issue (2013) Institutional Corruption and the Pharmaceutical Industry. Journal of Law Medicine and Ethics (JLME) https://papers.ssrn.com/sol3/papers.cfm?abstract_id=2298140
[26] Marks J (2019) The Perils of Partnership: Industry Influence, Institutional Integrity, and Public Health USA.Oxford: Oxford University Press
Weiteres relevantes Material
IBFAN-GIFA www.gifa.org/international/conflits-dinterets
Publikationen von Judith Richter: www.ibme.uzh.ch/en/Biomedical-Ethics/Team/Affiliates/judithrichter.html
Interessengruppen auf den Leim gegangen?
Projekt des Gesundheitsministeriums trifft auf breite Kritik
Am 19. Februar wurde der Global Health Hub Germany offiziell der Öffentlichkeit präsentiert. Teile der Zivilgesellschaft blieben der Veranstaltung, die viele Fragen offen ließ, fern. Zentrale Aspekte sind nach wie vor unklar, etliche KritikerInnen sehen weiterhin keinen Bedarf für dieses neue Gremium.
Mit einer gut dreistündigen Veranstaltung eröffnete das Bundesministerium für Gesundheit (BMG) am 19. Februar in Berlin den so genannten Global Health Hub Germany (GHHG). Das vom Ministerium geförderte neue Gremium soll nach eigenem Bekunden Akteure aus Politik, Zivilgesellschaft, Wissenschaft und Wirtschaft zusammenbringen, um die nachhaltigen Entwicklungsziele der Vereinten Nationen im Bereich Gesundheit und Partnerschaften voranzubringen.
Schon im Vorfeld hatten allerdings etliche Organisationen umfangreiche Kritik an der Plattform und ihrer Entstehung geäußert (wir berichteten [1],[2]). Sie bemängelten, dass das Projekt von der Wirtschaft lanciert und in einem wenig transparenten Prozess gegen Vorbehalte anderer Ministerien sowie von Teilen der Zivilgesellschaft durchgedrückt worden sei.
Bleibende Baustellen
Einige Organisationen, darunter auch die BUKO Pharma-Kampagne, blieben den Feierlichkeiten aus Protest fern. Gemeinsam mit der Deutschen Plattform globale Gesundheit veröffentlichten wir eine Pressemitteilung , die den inhärenten Konflikt des Gremiums zwischen Gemeinwohlinteressen und Gewinninteressen im Gesundheitsbereich hervorhob: „Wenn ein Global Health Hub etwas erreichen soll, darf er nicht den Interessen der Wirtschaft Vorrang einräumen.“ [3]
Angesichts der Kontroversen um den Hub ist es befremdlich, dass in dem Event kein Platz für kritische Stimmen aus dem Plenum vorgesehen war. Als Agendapunkt fand sich zwar eine „Live-Umfrage mit Teilnehmern“ (sic!) – die dafür veranschlagte Zeit betrug jedoch ganze fünf Minuten und TeilnehmerInnen konnten lediglich digital auf wenige ausgewählte Fragen antworten. Wirklich negative Optionen waren nicht vorgesehen.
Der Zivilgesellschaft wurde unter dem Punkt „Stimmen der Akteursgruppen“ immerhin ein kurzes Statement eingeräumt. Das vorgegebene Zeitfenster: zwei Minuten. Bemängelt wurde in dem Beitrag von Gisela Schneider (Difäm), es bleibe nach wie vor unklar, was das genaue Ziel des GHHG sein solle. Zudem seien zentrale Fragen, etwa zur Leitung und Lenkung, Mitgliederauswahl oder Themen-Selektion weiterhin ungeklärt. Entsprechende Infos bleibt auch der sechsseitige Flyer auf der neuen Website des GHHG schuldig.[4]
Heike Baehrens (MdB) zeigte sich auf dem Podium irritiert, dass weder das Bundesministerium für wirtschaftliche Zusammenarbeit und Entwicklung (BMZ) noch das Bundeministerium für Bildung und Forschung (BMBF) prominent vertreten waren. Überraschend kam dies allerdings nicht, hatte das BMG doch bei seinem Vorstoß in der Vergangenheit beide Ressorts zunächst mehr oder minder übergangen. Sowohl der Vernetzungsgedanke, den der Hub für sich selbst postuliert, aber auch eine nachhaltige, kohärente Politik wurden hier lediglich parodiert.
Vorgeben statt anhören
Bemerkenswert auch die Themensetzung. Bundesgesundheitsminister Jens Spahn präsentierte beim Launch des GHHG vier Arbeitsfelder, um die sich der Hub zunächst kümmern wird: Antibiotika-Resistenzen, Digitalisierung, Krebsbekämpfung und Tropenkrankheiten.[5] Diese Auswahl erfolgte wohlgemerkt nicht über ein Votum der Mitglieder des Hubs, die es zum Zeitpunkt der Gründung ja noch gar nicht geben konnte.
Die Vorgehensweise ist symptomatisch für die paradoxe Vorgehensweise des Hubs. Anstatt in einem ersten Schritt Meinungen zu den Prioritäten anzuhören, sind die Eckpfeiler von einer Gruppe undurchsichtiger Zusammensetzung schon vorab eingeschlagen.
Ein zweites Beispiel zeigt ebenfalls den frappierenden Gegensatz zwischen formuliertem Anspruch und Realität: Selbst die Key-Note mit dem plakativen Titel „Warum braucht es einen Global Health Hub Germany?“ konnte letztlich keine befriedigende Antwort auf eben jene Frage geben. „Wir müssen untypische Partnerschaften fördern, damit die Global Health Familie größer wird“, so die Vortragende Frau Ilona Kickbusch (Global Health Centre).[6] Unspezifischer und inhaltsleerer geht es kaum. Durch die gewählte Terminologie „Familie“ werden real existierende Interessengegensätze zugekleistert und unkritisch Public Private Partnerships propagiert.
Im Vergleich zu bereits bestehenden Strukturen ist der GHHG in seiner jetzigen Form kein innovativer Ansatz. Die NGOs sind gut vernetzt und sprechen auch mit Politik, Wissenschaft, Gewerkschaften und Unternehmen. Letztlich liegt in der hoch problematischen Genese der Hase im Pfeffer. Es sei daran erinnert, dass der GHHG konzipiert wurde, ohne dass zuvor alle eingeplanten Akteursgruppen überhaupt im Rahmen einer Bedarfsanalyse zur Notwendigkeit Gehör fanden. Die Zivilgesellschaft erfuhr erst spät und auf Umwegen von dem Projekt. Wirtschaft und philanthropische Stiftungen hingegen hatten den Prozess von Beginn an geprägt. Bedarf wurde also offenbar vor allem von diesen Gruppierungen angemeldet.
Was vom Abend übrig blieb
Die während des Launch verkündeten ersten Themenschwerpunkte der Plattform (s.o.) verweisen dann auch entsprechend deutlich auf diese eingebaute Schräglage. So bietet beispielsweise gerade der Bereich Digitalisierung für Akteure der Wirtschaft ein äußerst lukratives Betätigungsfeld.
Die von Bundesminister Spahn auf der Veranstaltung verkündete finanzielle Unterstützung eines WHO-Programms zu vernachlässigten Tropenkrankheiten fand ihren Widerhall in der direkten Ankündigung der Gates-Stiftung, ebenfalls Förderung in Millionen-Höhe beizusteuern. Von glücklichen Zufällen mag man hier nicht ausgehen.
Es steht zu befürchten, dass der Hub als Vehikel von Eigeninteressen der Beteiligten auch andere Prozesse zu globaler Gesundheit beeinflussen könnte, etwa die neue globale Gesundheitsstrategie der Bundesregierung. Dies gilt umso mehr, sollte sich der Hub im Laufe der Zeit tatsächlich zum Hauptanlaufpunkt für Themen globaler Gesundheit entwickeln und damit eine wichtige Gatekeeper-Funktion übernehmen. Akteure der Zivilgesellschaft sollten sich also ernsthaft überlegen, ob ihre Beteiligung am GHHG am Ende nicht vor allem als Feigenblatt dient.
Eine ehrliche und konstruktive Debatte, gerade zu einem so elementaren Thema wie Global Health, muss Kontroversen aushalten können, braucht sie letztlich sogar zwingend. Die neue Plattform des BMG scheint gerade das nicht zu bieten. Sie ist eher darauf ausgerichtet, den kritischen Diskurs einzuhegen und einer bereits vorab festgelegten Agenda zu folgen, statt einen transparenten und fairen Austausch mit Mehrwert zu stimulieren. Inwieweit dies von politischer Seite so intendiert war oder man hier den Interessen anderer auf den Leim gegangen ist, stellt eine der vielen offenen Fragen dar. (MK)
Artikel aus dem Pharma-Brief 1/2019, S. 1
[1] Pharma-Brief (2018) Bundesregierung hört zu. Nr. 7, S. 1
[2] Pharma-Brief (2018) Abgekartetes Spiel. Nr. 8-9, S. 1
[3] Deutsche Plattform für Globale Gesundheit (2019) Falsche Weichenstellung. Pressemitteilung 19. Feb. www.plattformglobalegesundheit.de/falsche-weichenstellung/ [Zugriff 19.02.2019]
[4] Global Health Hub Germany (2019) Menschen & Ideen zusammenbringen. Perspektiven erweitern. Themen setzen. www.globalhealthhub.de/#2 [Zugriff 20.02.2019]
[5] Bundesministerium für Gesundheit (2019) Bundesgesundheitsminister Jens Spahn: „Starkes deutsches Netzwerk für globale Gesundheit“. Pressemitteilung 19.02.2019. https://www.bundesgesundheitsministerium.de/presse/pressemitteilungen/2019/1-quartal/global-health-hub-germany.html [Zugriff 20.02.2019]
[6] Deutsches Ärzteblatt (2019) Bundesgesundheitsministerium fördert Netzwerk für Globale Gesundheit. www.aerzteblatt.de/nachrichten/101233 [Zugriff 21.02.2019]
Global gesunde Geschäfte
German Health Alliance der Wirtschaft
Die deutsche Wirtschaft will die globale Gesundheit stärken, so die Eigenwerbung der neu gegründeten „German Health Alliance“.[1] NGOs und staatliche Träger der Entwicklungshilfe sind mit im Boot. Wem nützt dieses „Public Private Partnership“ (PPP)?
Eigentlich ist die vom Bundesverband der deutschen Industrie (BDI) gegründete „German Health Alliance“ (GHA) nicht ganz frisch. Sie bündelt die Aktivitäten des BDI aus drei schon länger bestehenden Exportförder-Partnerschaften, darunter dem German Healthcare Partnership (GHP).[2] Letzteres war wiederum Ideengeber für den „Global Health Hub Germany“,
der vergangenes Jahr formal vom Bundesgesundheitsministerium ins Leben gerufen wurde (wir berichteten [3],[4]).
Etwas verwirrt über die vielen „Partnerschaften“? Dahinter könnte Methode stecken: Es kann gar nicht genug Foren geben, in denen man seine Meinung zu Gehör bringt. Um dem Ganzen mehr Legitimität zu verleihen, holt man sich einige NGOs an Bord und verstrickt Bundestagsabgeordnete – ein paar WissenschaftlerInnen als Garnitur machen sich auch nicht schlecht.
Die Industrie versucht mit aller Macht, den Diskurs über globale Gesundheit in ihr genehme Bahnen zu lenken. Die „German Health Alliance“ wird am 26.11.2019 aus der Taufe gehoben. Thema der Veranstaltung: „Deutschlands Rolle und Verantwortung in Globaler Gesundheit“. Als Ziel wird ausdrücklich genannt, „die Zusammenarbeit zu stärken und gemeinsam neue Wege zu beschreiten.“[5]
Es geht nicht nur um Exportförderung der deutschen Pharma- und Medizintechnikindustrie, sondern auch um möglichst günstige Rahmenbedingungen für die deutsche Wirtschaft. Durch den UN-Beschluss, Gesundheitsversorgung für alle (UHC[6]) hoch auf die politische Agenda zu setzen, locken größere Märkte.
Angesichts der massiven Kritik an hohen Preisen für Medikamente weltweit gilt es, eine harte Regulierung der Geschäfte zu verhindern. Und was hilft da besser, als möglichst viele AkteurInnen an den Tisch zu holen, um sie für die eigenen Zwecke einzuspannen. Und selbst wenn das nicht gelingt, hält man die Leute so beschäftigt.
Die GHA rühmt sich auch der engen Kooperation mit dem World Health Summit.[7] Dieses industrielastige jährliche Treffen zu globaler Gesundheit wird von Prof. Detlev Ganten, Vorsitzender des Stiftungsrats der Charité, geleitet. Was liegt da näher, als dass die GHA ihm am 26.11. auch den „German Global Health Award“ verleiht? Überreicht wird der Preis von Gesundheitsminister Jens Spahn. Die Laudatio hält Prof. Karl Max Einhäupl, ehemaliger Vorstandsvorsitzender, Charité. Ganten ist übrigens auch im Advisory Board der GHA – so schließen sich die Kreise. (JS)
Artikel aus dem Pharma-Brief 9/2019, S.1
[1] https://gha.health/ [Zugriff 19.11.2019]
[2] Die anderen sind German Healthcare Export Group (GHE) und die German-Sino Healthcare Group (GSHCG)
[3] Pharma-Brief (2018) Abgekartetes Spiel. Nr. 8/9, S. 1
[4] Pharma-Brief (2019) Gesundheitshub krankt. Nr. 4/5, S. 4
[5] GHA (2019) https://gha.health/wp-content/uploads/Programm_26112019_deutsch.pdf [Zugriff 19.11.2019]
[6] Universal Health Coverage
[7] https://ghp-initiative.de/about-us/ [Zugriff 20.11.2019]
Gesundheitshub krankt
Uneinigkeit bei Struktur und Mitbestimmung
Der Global Health Hub Germany (GHHG) bleibt ein Problemprojekt des Bundeministeriums für Gesundheit (BMG). Denn das Hauruck-Verfahren bei seiner Gründung rächt sich nun bei der Diskussion um die interne Entscheidungskultur. Obwohl der Hub schon Aktivitäten entfaltet, gibt es keine Satzung, die die Rechte von Mitgliedern und Lenkungskreis regelt.
Nach anhaltender externer Kritik, zuletzt etwa in einem Beitrag in welt-sichten,[1] rumort es mittlerweile vernehmlich in den „Eingeweiden“ des Hubs. Ursächlich dafür sind vor allem auch die Versäumnisse beim Aufbau des Prestige-Objekts (wir berichteten[2]).
Entzündet haben sich die Diskussionen innerhalb des GHHG vor allem an der Frage, wie die noch ausstehende Satzung aussehen soll und dabei besonders, in welchem Verfahren sie bearbeitet und verabschiedet werden wird. In einem Brief an das BMG und die Gesellschaft für Internationale Zusammenarbeit (GIZ) benennt Eva-Maria Schreiber, Bundestagsabgeordnete der Linken und Mitglied im Hub, das Problem:[3] Demnach sei ursprünglich zugesagt worden, die Satzung in einem transparenten Konsultationsprozess gemeinsam mit allen Mitgliedern zu erarbeiten – nun solle jedoch wohl zeitnah der Lenkungskreis allein eine finale Version verabschieden. Die GIZ bestreitet das. Mitglieder könnten bald im Intranet des Hubs Rückmeldungen zu der von GIZ und Lenkungskreis entworfene Satzung geben.
Dennoch stellen sich (mindestens) zwei kritische Frage. Zum Einen, auf welcher Grundlage der Interims-Lenkungskreis bei diesem Prozess eigentlich handeln kann. Zum Anderen, welche Rolle denn die Mitglieder des Hubs letztlich spielen, sofern basisdemokratisches Handeln wirklich angestrebt wird.
Henne, Hub und Ei
 Durch das Drängen des BMG, den GHHG möglichst schnell öffentlichkeitswirksam auftreten zu lassen, mangelt es ihm intern grundlegend an Verfahrensregeln. Dem wohlgemerkt extern bestimmten Interims-Lenkungskreis wurde nun unter Einbezug der nicht im Hub vertretenen GIZ die Rolle zugeschoben, diesen Schwachpunkt zu beheben. Der erster Entwurf für eine Satzung kam offenbar von der GIZ, die als Auftragnehmer des BMGs die Hub-Geschäftsstelle führt, dieser wurde dann vom Interims-Lenkungskreis diskutiert. Laut früherer Aussage des GHHG wird der Interims-Lenkungskreis auch schlussendlich die Kommentierung und Verabschiedung des Satzungsentwurfs vornehmen.[4]
Durch das Drängen des BMG, den GHHG möglichst schnell öffentlichkeitswirksam auftreten zu lassen, mangelt es ihm intern grundlegend an Verfahrensregeln. Dem wohlgemerkt extern bestimmten Interims-Lenkungskreis wurde nun unter Einbezug der nicht im Hub vertretenen GIZ die Rolle zugeschoben, diesen Schwachpunkt zu beheben. Der erster Entwurf für eine Satzung kam offenbar von der GIZ, die als Auftragnehmer des BMGs die Hub-Geschäftsstelle führt, dieser wurde dann vom Interims-Lenkungskreis diskutiert. Laut früherer Aussage des GHHG wird der Interims-Lenkungskreis auch schlussendlich die Kommentierung und Verabschiedung des Satzungsentwurfs vornehmen.[4]
Dabei wird er sich allerdings nicht auf transparente und faire Verfahrensweisen stützen können – diese werden ja erst in einer Satzung festgeschrieben. Die Auflösung der existenziellen Frage, ob erst die Henne oder das Ei kam, soll offenbar wie folgt „gelöst“ werden: Die Henne legt einfach das Ei, aus dem sie dann schlüpft. Leidtragende ist hier die breite Mitgliederschaft, der eine umfangreiche Mitbestimmung in Aussicht gestellt worden war.
Kommt alles Gute von oben?
Im April kommunizierte das BMG, der Hub habe bereits fast 170 Mitglieder. Die blieben bisher allerdings weitgehend ohne direkten Einfluss, konnten lediglich beim so genannten Global Health Talk Mitte Juni erste Arbeitsgruppen gründen.[5]
Die übergeordneten Schwerpunktthemen hatte das BMG vorsorglich schon beim Start des Hub selbst festgelegt.[6] Auch der erste Lenkungskreis war vorab bestimmt worden. Es hat also schon eine gewisse Tradition, dass die Mitglieder bei den fundamentalen Entscheidungen nur begrenzt mitreden können. Momentan deutet wenig darauf hin, dass sich dies bei Ausarbeitung und Annahme der Satzung ändern könnte. Denn selbst wenn irgendwann noch digitale Rückmeldungen aufgenommen werden, ist momentan völlig unklar, ob und wie genau diese berücksichtigt werden.
Die Möglichkeit einer zeitnahen, ersten Mitgliederversammlung mit Debatte und Abstimmung über einen Satzungsentwurf, der schließlich elementar für die künftige Ausrichtung und Arbeit des Hub ist, wurde offenbar gar nicht ernsthaft erwogen. Für ein Projekt, bei dem Partizipation angeblich groß geschrieben werden sollte, ist dieses Zwischenzeugnis verheerend und wachsender Unmut verständlich. Es steht zu erwarten, dass es für den GHHG noch ein heißer Sommer wird. (MK)
Artikel aus dem Pharma-Brief 4-5/2019, S.4
Bild Henne bunt © luna4 /iStock
[1] welt-sichten (2019) Hype um den Hub. www.welt-sichten.org/artikel/36147/hype-um-den-hub [Zugriff 23.07.2019]
[2] Pharma-Brief (2019) Neues aus dem Nebel. Nr. 2, S. 4-5.
[3] Der Brief ist einsehbar unter https://www.eva-maria-schreiber.de/de/article/217.brief-an-giz-konsultationsprozess-zur-satzung-des-global-health-hubs.html [Zugriff 24.07.2019]
[4] Global Health Hub Germany (2019) Auftaktsitzung Interims-Lenkungskreis Global Health Hub Germany. www.globalhealthhub.de/de/news/auftaktsitzung-interims-lenkungskreis-global-health-hub-germany [Zugriff 23.07.2019]
[5] Global Health Hub Germany (2019) #GlobalHealthTalk2019 – Auftakt für die akteursübergreifende Zusammenarbeit des Global Health Hub Germany. www.globalhealthhub.de/de/news/globalhealthtalk2019-auftakt-fuer-die-akteursuebergreifende-zusammenarbeit-des-global-health [Zugriff 23.07.2019]
[6] Pharma-Brief (2019) Interessengruppen auf den Leim gegangen? Nr. 1, S. 1
Europäische Nutzenbewertung
Wie geht es weiter?
Über den Gesetzentwurf der EU-Kommission für eine einheitliche Nutzenbewertung von Arzneimitteln haben wir wiederholt berichtet.[1],[2],[3] Parlament und Ministerrat sind sich nicht einig. Wie geht es nach der Europawahl weiter?
Auch wenn dem wirtschaftsfreundlichen Entwurf der Kommission durch intensive Öffentlichkeitsarbeit von kritischen NGOs und Proteste der Fachwelt die meisten Giftzähne gezogen wurden, bleiben nach dem im Oktober 2018 vom EU-Parlament beschlossenen Entwurf Fragezeichen.
Abgeordnete wollen gehört werden
Das Parlament hat im Februar 2019 nochmals seinen Standpunkt bekräftigt.[4] Es möchte, dass auch nach der Europawahl auf Basis seines Beschlusses weiterverhandelt wird. Das ist im Gegensatz zum Bundestag, wo vor einer Wahl nicht abgeschlossene Gesetzgebungsverfahren komplett neu gestartet werden müssen, in der EU möglich. Die EU-Abgeordneten warnten mit ihrem Beschluss die Kommission davor, das Gesetz ohne vorherige Konsultation des Parlaments umzuschreiben.
Der Ministerrat hatte im November 2018 noch einmal strittige Punkte festgehalten.[5] Im Kern geht es um die Möglichkeit, nach wie vor nationale Entscheidungen über die Erstattungsfähigkeit von Arzneimitteln treffen zu können. „Eine große Mehrheit der Delegationen vertritt die Auffassung, dass – falls erforderlich – auch nationale klinische Bewertungen möglich sein müssen.“ Damit befinden sich die Mitgliedsstaaten im Widerspruch zu der Auffassung des Parlaments. Außerdem mahnten die Staaten an, dass eine gemeinsame europäische Nutzenbewertung „mindestens so gut“ wie nationale Bewertungen sein müssen. Das Verfahren müsste maximal transparent gestaltet werden und „strikte Regeln für Interessenkonflikte“ eingefügt werden, „um einen unabhängigen Bewertungsprozess zu garantieren.“
Da sich Parlament, Kommission und Ministerrat über den Entwurf einigen müssen, bleibt es auch nach der Europawahl spannend. (JS)
Artikel aus dem Pharma-Brief 2/2019, S. 2
[1] Pharma-Brief (2018) Wunschkonzert für Hersteller. Nr. 3, S. 1
[2] Pharma-Brief (2018) Zwischen Kommerz und Transparenz. Nr. 6, S. 5
[3] Pharma-Brief (2018) EU-HTA Update 2. Nr. 7, S. 6
[4] Europäisches Parlament (2019) Bewertung von Gesundheitstechnologien. P8_TA-PROV (2019)0120. Legislative Entschließung 14. Feb. 2019
[5] Council of the European Union (2018) Interinstitutional File 2018/0018 (COD) 14694/18, 30 Nov 2018
Essenzielle Probleme
Listen unentbehrlicher Arzneimittel sind oft nicht kohärent
Seit über 40 Jahren gibt es die Modelliste für unentbehrliche Arzneimittel der Weltgesundheitsorganisation (WHO). Die meisten Länder der Welt nutzen angepasste nationale Listen für ihre Gesundheitsversorgung. Doch die Auswahl der Wirkstoffe scheint nicht immer optimal. Und die hohen Preise für viele neue Präparate stellen ein ernstes Zugangshindernis dar.
Eine sinnvolle Auswahl an Medikamenten zu treffen, die in einem Gesundheitssystem verfügbar sein sollen, gilt international als Eckpfeiler für eine gute Versorgung. Der Zugang zu unentbehrlichen Arzneimitteln ist als Ziel in den Nachhaltigen Entwicklungszielen (SDGs) der Vereinten Nationen verankert. Nur wenige Länder – darunter auch Deutschland – leisten sich den Luxus, ohne Rücksicht auf den Nutzen (fast) alle Medikamente zu erstatten.
Die alle zwei Jahre aktualisierte Liste unentbehrlicher Arzneimittel der WHO ist ausdrücklich als Modellliste konzipiert. Sie bietet einen Orientierungsrahmen für nationale Listen. Länder sollen sie nach ihren lokalen Bedürfnissen (und finanziellen Möglichkeiten) ergänzen und nicht benötigte Mittel streichen. Auffällig sind aber die extremen Unterschiede bei den Listen, die sich nicht allein durch unterschiedliche Krankheitslast und Budgetbeschränkungen erklären lassen.
ForscherInnen von zwei öffentlichen Einrichtungen in Kanada und Großbritannien[1] haben gemeinsam mit MitarbeiterInnen der WHO die 137 vorhandenen nationalen Listen unter die Lupe genommen.[2] Auf den Listen fanden sich zusammengenommen 2.068 verschiedene Wirkstoffe. Davon tauchten allerdings 1.248 nur in zehn oder weniger nationalen Listen auf.
Die Spannbreite der Wirkstoffe ist groß, von 44 bis fast 1.000 Medikamente umfassen die Listen je nach Land. Dabei sind sie in ärmeren Ländern oft kürzer, es lässt sich aber kein eindeutiger Zusammenhang mit dem Bruttosozialprodukt erkennen. Spitzenreiter ist die Slowakei mit 983 Medikamenten auf ihrer Liste, dicht gefolgt von Syrien mit 964. Das reiche Schweden kommt hingegen mit 289 Wirkstoffen aus.
Auffälliger noch sind die Abweichungen von den 414 Wirkstoffen auf der WHO-Modellliste von 2017.[3],[4] 73 Wirkstoffe fanden sich nur auf 20% aller nationalen Listen wieder. Dagegen fanden sich rund 100 Medikamente auf fast allen Listen (>80%) wieder. Einige Listen weisen eine hohe Ähnlichkeit mit der WHO-Liste auf, d.h. die meisten der für die nationale Liste gewählten Wirkstoffe stehen auch auf der WHO-Liste, die Zahl der zusätzlichen aufgeführten Arzneimittel ist gering. Die höchste Übereinstimmung weist Pakistan mit 93% auf: Von den 373 Medikamenten auf der nationalen Liste finden sich 347 auch in der WHO-Modellliste.
Andererseits gibt es auch eine Vielzahl von Listen mit einer nur geringen Überschneidung mit dem WHO-Modell. Das liegt oft auch an der großen Zahl zusätzlicher Medikamente, die in die nationale Liste aufgenommen wurden. So finden sich von den 707 Medikamenten auf der äthiopischen Liste nur 319 (45%) auf der WHO-Liste wieder. Stärker ist die Abweichung in der oben schon erwähnten langen syrischen Liste, sie stimmt nur zu 32% mit der Modellliste überein.
Ein weiterer Schwachpunkt sind fehlende Aktualisierungen vieler nationaler Listen: Nicht wenige sind bis zu zehn Jahre alt.
Überprüfung notwendig
Die AutorInnen regen eine kritische Überprüfung der Listen auf nationaler Ebene an. Sämtliche Ergebnisse ihrer Untersuchung haben sie in einer leicht durchsuchbaren Datenbank hinterlegt.[5] Als Warnsignal sehen sie Wirkstoffe, die sich weltweit nur auf wenigen Listen finden. Ein Beispiel dafür ist Acarbose, ein sehr wahrscheinlich unwirksames Mittel gegen Diabetes,[6] das in 21 Ländern gelistet ist.[4]
Eine Schwierigkeit scheint die unzureichende Evidenzbasis für etliche nationale Entscheidungen zu sein. Allerdings ist hier die WHO-Modellliste auch kein gutes Vorbild. Die Auswahl basiert weitgehend auf einem ExpertInnenkonsens. Das Selektionsverfahren fällt weit hinter die heute üblichen Standards der Nutzenbewertung von Arzneimitteln zurück, die in vielen Industrieländern angewandt werden.
Preise als Problem
In die neueste WHO-Liste von 2019 wurden zehn neue Krebsmedikamente aufgenommen.[7] Bereits Industrieländer haben mit den hohen Kosten für diese Medikamente zu kämpfen, die Jahrestherapiekosten liegen oft über 50.000 €. Umso wichtiger ist es, dass diese Medikamente in ärmeren Ländern preisgünstig zur Verfügung stehen. Das ist aber oft nicht der Fall und häufig auch ein Grund, warum Medikamente nicht auf die nationalen Listen unentbehrlicher Arzneimittel kommen. Als Beispiel nennen VertreterInnen von NGOs und WissenschaftlerInnen den Wirkstoff Lenalidomid, der gegen das multiple Myelom eingesetzt wird und dieses Jahr auf die WHO-Liste kam.[8] Bis 2016 war Lenalidomid in Südafrika als Generikum verfügbar, die Jahrestherapiekosten betrugen pro PatientIn 2.289 US$. Dann registrierte Celgene sein Markenpräparat in Südafrika, seitdem kostet es 51.000 US$ pro PatientIn und ist deshalb im öffentlichen Gesundheitssektor, der 84% der Bevölkerung versorgt, nicht mehr verfügbar. Die Herstellungskosten für den Wirkstoff werden auf 2,55 US$ für eine Monatsbehandlung geschätzt. In Indien wurde der Patentantrag für Lenalidomid abgelehnt, dort ist das Präparat für rund 2.000 US$ verfügbar – ein Preis, der für viele InderInnen außerhalb ihrer Möglichkeiten liegt.
Das von der Industrie oft vorgebrachte Argument, dass die Forschungskosten die hohen Preise rechtfertigen, ist aus zwei Gründen nicht stichhaltig: Erstens sind PatientInnen, die sich die Medikamente aus Preisgründen nicht leisten können, sowieso kein Markt für die Hersteller. Eine Abgabe zu Herstellungskosten würde also keinen Verlust für die Firmen darstellen. Zweitens steht die Rechtfertigung an sich auf tönernen Füßen: Die WHO hat die Forschungsausgaben für 99 Krebsmedikamente, die zwischen 1989 und 2017 in den USA auf den Markt kamen, mit den erzielten Umsätzen für diese Mittel verglichen. Dabei kamen sie auf einen durchschnittlichen Umsatz von 14,50 US$ für jeden in die Forschung investierten Dollar (einschließlich Kosten für Fehlschläge).[9] Krebsmedikamente sind also ein äußerst lukratives Geschäft. Leider eines das auf Kosten der Armen dieser Welt geht.
Gesundheitsversorgung für Alle ist ein erklärtes Ziel der Vereinten Nationen. Dazu gehört eine rationale Auswahl der verwendeten Medikamente ebenso wie die Senkung der Preise auf ein bezahlbares Maß. (JS)
Artikel aus dem Pharma-Brief 4-5/2019, S.1
Bild Pillen © ironstealth /istock
[1] Centre for Urban Health Solutions, University of Toronto und Centre for Evidence-Based Medicine, University of Oxford
[2] Persaud N et al. (2019) Comparison of essential medicines lists in 137 countries. Bull WHO; 97, p 394
[3] WHO (2017) 20th Essential Medicines List. www.who.int/medicines/news/2017/20th_essential_med-list/en
[4] Bei etlichen Wirkstoffen sieht die WHO eine Äquivalenz innerhalb der Wirkstoffgruppe (in der WHO-Liste mit einem Quadrat markiert). Bei diesen Wirkstoffen wurde in der vorliegenden Untersuchung die Gleichwertigkeit angenommen und die nationale Auswahl wurde in diesem Fall nicht als Abweichung von der WHO-Liste gewertet.
[5] https://global.essentialmeds.org [Zugriff 12.7.2019]
[6] arznei-telegramm (2017) Arzneimitteldatenbank [Zugriff 12.7.2019]
[7] ‚t Hoen E et al. (2019) Improving affordability of new Essential Cancer Medicines. Lancet Oncol http://dx.doi.org/10.1016/S1470-2045(19)30459-0
[8] WHO (2019) 21th Essential Medicines List. https://apps.who.int/iris/handle/10665/325771
[9] WHO (2018) Pricing of cancer medicines and its impacts. Geneva: WHO https://apps.who.int/iris/bitstream/handle/10665/277190/9789241515115-eng.pdf
Die schmutzige Rückseite der Medaille
UN verletzt eigene Prinzipien durch fragwürdige Kooperationen
Public-Private-Partnerships[1] (PPPs) zwischen staatlichen und privaten Akteuren finanzieren weltweit zahlreiche (semi-)öffentliche Projekte. Ein kürzlich erschienenes Arbeitspapier von MISEREOR, Brot für die Welt und Global Policy Forum wirft einen kritischen Blick auf die Partnerschaften der UN.[2]
PPPs sind nicht nur auf nationaler Ebene im Trend, um das Problem knapper öffentlicher Gelder zu umgehen. Auch die Vereinten Nationen (UN) setzen bei der Umsetzung ihrer Ziele für nachhaltige Entwicklung (Sustainable Development Goals, SDGs) vermehrt auf die Zusammenarbeit mit privaten Unternehmen. Die zunehmende Verstrickung der Wirtschaft in Projekte und Politik der UN birgt jedoch einige Risiken. Wirtschaftsakteure verfügen im Vergleich zu zivilgesellschaftlichen Akteuren ohnehin bereits über einen besseren Zugang zu den Entscheidungsprozessen in der UN. Durch die PPPs und die damit einhergehenden stärker formalisierten Beziehungen droht sich das Ungleichgewicht zwischen wirtschaftlichen und zivilgesellschaftlichen Interessen in der globalen Politik noch mehr auszuweiten.
Gleichzeitig gibt es mehrere Fälle von sogenanntem Bluewashing, also dem Schönfärben des Unternehmens durch eine Kooperation mit der UN. Dabei soll die Assoziation mit der UN und der vermeintliche Einsatz für die SDGs das Image des Unternehmens aufbessern, obwohl die tatsächliche Unternehmenspraxis nicht mit den Nachhaltigkeitszielen vereinbar ist.
Ein Beispiel dafür ist die Partnerschaft zwischen der Bill & Melinda Gates Stiftung und der WHO. Die philanthropische Stiftung investiert gleichzeitig in Unternehmen der Nahrungsmittel- und Getränkeindustrie, wie Coca-Cola, Walmart und dem weltweit größten Franchiseträger von McDonalds. Die finanziellen Bindungen zu diesen Konzernen stehen im völligen Gegensatz zu den Werten der WHO und den Nachhaltigkeitszielen der UN. Hieran wird deutlich, dass die Interaktion zwischen UN und Wirtschaft nicht ausreichend geregelt ist. Daher fordern die AutorInnen strengere, aber vor allem allgemein gültige und angewendete Regularien, anhand derer potentielle Partnerschaften von UN-Institutionen mit Akteuren aus dem privaten Sektor gemessen werden sollen. (MB)
Artikel aus dem Pharma-Brief 10/2019, S. 6
[1] Public-Private-Partnership ist zwar in diesem Kontext der übliche Begriff, dennoch erachten wir ihn als unpassend, da die Einordnung als Partnerschaft eine Beziehung auf Augenhöhe und mit gemeinsames Zielen suggeriert. In der Realität stehen die öffentlichen und unternehmerischen Ziele häufig im Kontrast zueinander.
[2] Martens J and Seitz K (2019) Rules of engagement between the UN and private actors. Towards a regulatory and institutional framework. p. 10. www.globalpolicy.org/images/pdfs/Rules_of_Engagement_UN_Private_Actors_web.pdf [Zugriff 10.10.2019]
Deutsche Kurzfasssung: Seitz K (2019) Nachhaltig nur auf dem Papier? Die ambivalente Rolle der Wirtschaft bei der Umsetzung der SDGs. S.3. www.globalpolicy.org/images/pdfs/Briefing_0319_Nachhaltig_nur_auf_dem_Papier.pdf [Zugriff 10.10.2019]
Die nächste Schlappe
Brustkrebsmedikament bleibt ohne Zusatznutzen
Das Krebsmedikament Palbociclib war mit viel Vorschusslorbeeren gestartet. Doch nun kommt der nächste Dämpfer. Der Gemeinsame Bundesausschuss entschied nach gründlicher Auswertung einer zweiten Studie endgültig, dass es keinen zusätzlichen Nutzen gibt.
Zur Erinnerung: Mit drei Studien versucht(e) der Hersteller die Vorteile von Palbociclib[1] zu belegen: Mit Paloma 1 und 2 für Frauen mit Brustkrebs in der Erstlinientherapie[2] und mit Paloma 3 für Frauen nach Vortherapien.[3] Bei der Zulassung war keine der drei Studien abgeschlossen und Vorteile für das Überleben waren noch nicht belegt.[4] Die erste Nutzenbewertung vom Mai 2017 durch den Gemeinsamen Bundesausschuss (G-BA) [5] verlief für alle Patientinnengruppen negativ, das Urteil lautete „kein Zusatznutzen“ für Palbociclib. Da zum Zeitpunkt der Beschlussfassung alle Studien noch liefen bzw. keine endgültigen Ergebnisse vorlagen, war der Beschluss befristet.[6]
Bereits direkt nach diesem Beschluss wurden die Endergebnisse von Paloma 1 bekannt: Kein Überlebensvorteil für die betroffenen Frauen – aber mehr Nebenwirkungen.[4] Im Sommer 2018 wurden die Endergebnisse von Paloma 3 für die Behandlung von Frauen, die bereits Vortherapien erhalten hatten, bekannt: In dieser Studie sicherte Palbociclib ebenfalls kein längeres Überleben. Obwohl der Hersteller versuchte, die Resultate schönzurechnen,[7] blieb der G-BA jetzt in einer neuen Bewertung bei seinem ursprünglichen Urteil, dass für diese Patientinnen kein Zusatznutzen durch den neuen Wirkstoff belegt ist.[8]
Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hatte dafür die Daten des Herstellers genau unter die Lupe genommen und der G-BA sich in der anschließenden Diskussion große Mühe gegeben. Der G-BA hob mehrere Kritikpunkte hervor. So wurden nachträglich mehr Frauen in die Studie aufgenommen als ursprünglich geplant – und das, wo für den Hersteller nicht so erfreuliche Zwischenergebnisse schon bekannt waren. Das riecht nach Manipulation. Mindestens ebenso wichtig: Ungewöhnlich viele Frauen waren während der Paloma 3-Studie „verlorengegangen“, für sie lagen keine Daten zum Überleben vor. Dass die für diese Patientinnengruppe gewählte Vergleichstherapie Fulvestrant als alles andere als optimal gilt, ist ein weiterer Schwachpunkt.
Nachdem nun für drei von vier Patientinnengruppen das Urteil „kein Zusatznutzen“ feststeht, bleibt als letzter Rettungsanker für den Hersteller für die Erstlinientherapie bei Frauen nach der Menopause nur noch die Paloma 2-Studie. Bisherige Zwischenergebnisse zeigen aber (noch) keinen Überlebensvorteil. Und die Dauer der Studie wurde schon zweimal verlängert, um doch noch positive Ergebnisse zu erzielen. Die erste Frist zur Vorlegung der Daten beim G-BA lief bis zum 1.3.2019, aber der Hersteller signalisierte schon letztes Jahr, dass er sie nicht einhalten kann. Jetzt müssen die Daten bis zum 2.1.2021 vorgelegt werden.
Man rufe sich in Erinnerung: Ende 2016 wurde Palbociclib aufgrund wenig tragfähiger Daten zugelassen. Erst vier Jahre danach kann eine aussagekräftige Bewertung des Nutzens für eine nicht unwesentliche Gruppe von PatientInnen begonnen werden. Klarheit, ob wenigstens eine Patientinnengruppe von dem Medikament profitiert, gibt es also erst Mitte 2021 nach Abschluss der Bewertung durch den G-BA.
Wem nützt es?
Der Wirkstoff kostet über 66.000 € pro Patientin und wird zusätzlich zur bisherigen Medikation gegeben. Für den Hersteller ein gutes Geschäft.
Für Frauen, die von Brustkrebs betroffen sind, sind die Ergebnisse der unabhängigen Bewertung von Palbociclib enttäuschend. Denn sie hoffen zu Recht auf bessere Behandlungsmöglichkeiten. Allerdings darf man dabei nicht aus den Augen verlieren, dass der Hersteller den Hype um das Medikament kräftig geschürt hat. Leider machen leere Versprechen niemand gesund. (JS)
Artikel aus dem Pharma-Brief 2/2019, S. 6
[1] Palbociclib ist zugelassen für Hormonrezeptor (HR)-positiven, humanen epidermalen Wachstumsfaktor-Rezeptor-2(HER2)-negativen lokal fortgeschrittenen oder metastasierten Brustkrebs
[2] Zur Erstlinientherapie in Kombination mit einem Aromatasehemmer
[3] In Kombination mit Fulvestrant bei Frauen, die zuvor eine endokrine Therapie erhielten
[4] Pharma-Brief (2017) Viel Lärm um nichts? Nr. 4, S. 4
[5] G-BA Beschluss vom 18.5.2017 www.g-ba.de/bewertungsverfahren/nutzenbewertung/269/#tab/beschluesse
[6] Ausnahme: Erstlinientherapie bei Frauen vor der Menopause. Dazu hatte der Hersteller keine Studie durchgeführt. Für diese Patientinnengruppe war der Beschluss vom 18.5.2017 endgültig.
[7] Pharma-Brief (2018) Brustkrebs: Leere Versprechen. Nr. 6, S. 4
[8] G-BA (201) Beschluss vom 22.3.2019 www.g-ba.de/bewertungsverfahren/nutzenbewertung/394/#tab/beschluesse
Die Kultur verändern
Bessere Kommunikation verbessert Antibiotika-Verordnungen
2016 gründeten Kinder- und Jugendärzte in Bielefeld das Projekt AnTiB (Antibiotische Therapie in Bielefeld). Ihr Ziel: Auf lokaler Ebene für den ambulanten Bereich einheitliche, praxistaugliche und möglichst breit akzeptierte Regeln zur Verschreibung von Antibiotika zu entwickeln. Roland Tillmann, Kinderarzt und Mitbegründer der Initiative gibt Auskunft über die selbstgesteckten Ziele, erste Erfolge und Zukunftsperspektiven.
Herr Tillmann, gab es einen konkreten Anstoß für die Gründung von AnTiB?
Im Verschreibungsverhalten von ÄrztInnen gibt es sehr große Unterschiede. Das führt im Arbeitsalltag zu Konflikten – mit den Patienten bzw. mit besorgten Eltern, denen man die unterschiedliche Herangehensweise erklären muss, aber auch mit den Kollegen anderer Fachrichtungen oder aus anderen Sektoren. Jemand, der Antibiotika zurückhaltend und nur gezielt verordnet, sieht sich immer wieder solchen Konflikten ausgesetzt. Da gab es also fachlichen und persönlichen Leidensdruck.
Andererseits existieren in Bielefeld schon länger gute Kommunikationsstrukturen – etwa mit der Initiative Bielefelder Hausärzte und der Kinderklinik Bethel. Was fehlte war eine gemeinsame Kommunikationsstrategie. Aber dieses Potenzial konnte man nutzen, um das Verschreibungsverhalten besser abzustimmen. Das haben wir getan und Anfang 2017 erstmals Empfehlungen zur Antibiotika-Verordnung in der ambulanten pädiatrischen Versorgung erarbeitet und veröffentlicht.
Wie genau geschah das?
Niedergelassene Kinderärzte und Vertreter der örtlichen Kinderklinik haben das Projekt gestartet. In einem mehrstufigen, moderierten Kommunikationsprozess haben wir uns auf Empfehlungen zur Standardbehandlung häufiger Infektionskrankheiten verständigt. Am Ende stand ein breiter Konsens über eine einheitliche Verordnungspraxis – kurz gefasst, anwendungs- und anwenderorientiert. Immer wieder wurden Beiträge per E-Mail herumgeschickt, zur Diskussion gestellt und Kommentare von Kollegen eingearbeitet. Um eine externe Qualitätssicherung zu garantieren, wurden zudem Experten der Deutschen Gesellschaft für pädiatrische Infektiologie (DGPI) in den Prozess einbezogen.
Was war das erklärte Ziel?
Konkretes Ziel war, die Schnittstellenproblematik zu verbessern. Wenn eine Mitbehandlung z.B. im Notdienst oder in der Klinik stattfindet, sollte es eine bessere Zusammenarbeit und eine einheitliche Gesprächsführung mit dem Patienten geben. Das haben wir erreicht.
Den Antibiotikaverbrauch zu reduzieren, war zunächst gar nicht so sehr unsere Intention gewesen. Diese Zielsetzung rückte erst durch die Deutsche Antibiotika-Resistenzstrategie (DART)[1] der Bundesregierung in den Fokus. Damit hat das Projekt einen neuen Charakter bekommen. DART schlägt ja als Maßnahme u.a. die Erarbeitung von Konzepten zur Erstellung und Anwendung lokaler Leitlinien und Empfehlungen im ambulanten und stationären Bereich vor. Lokale Antibiotika-Leitlinien für die ambulante Medizin gab es aber vorher nicht. Andere Projekte wurden von universitären Einrichtungen angestoßen und legen den Schwerpunkt auf externe Schulungen. Die entscheidende Besonderheit von „AnTiB“ ist, dass das Projekt von der Basis ausging, also eine Initiative von praktizierenden Ärztinnen und Ärzten ist.
30 bis 50 Prozent aller Antibiotika werden laut Schätzungen ohne medizinische Notwendigkeit verschrieben. Warum ist es trotz zahlreicher Leitlinien und Fortbildungen so schwer, das Verschreibungsverhalten zu verändern?
Antibiotika-Verordnungen finden auch in einem sozialen Kontext statt. Da spielen z.B. die Macht von Erfahrungen und Gewohnheiten und auch vermutete Erwartungshaltungen eine Rolle und Entscheidungen unter Zeitdruck.
… wie kann AnTiB darauf Einfluss nehmen?
Indem wir Verordnungen nicht nur als individuelles Verhalten sehen, sondern auch als ein kulturelles Phänomen. Verordnungen werden nicht automatisch besser, wenn wir nur mehr infektiologisches Wissen verbreiten. Wir müssen vielmehr Normen bzw. die Kultur verändern, die den Entscheidungen auch zugrunde liegen. Eine Studie spricht hier von „local cultural unspoken rules“, also verdeckten kulturellen Regeln. In Nordrhein-Westfalen werden z.B. fast 50 Prozent mehr Antibiotika verschrieben als in den östlichen Bundesländern. Und auch an den Ländergrenzen – etwa zu den Niederlanden – ändert sich das Verschreibungsverhalten. Es geht also um kulturelle Unterschiede.
Genau hier setzt AnTiB an: Denn die lokale Ebene ist der Ort, wo wir den sozialen Kontext verändern und neue Normen prägen können, indem wir uns austauschen, miteinander Absprachen treffen.
Warum spielt dabei gerade der ambulante Bereich eine große Rolle?
85 Prozent aller humanmedizinischen Antibiotika-Verordnungen entfallen auf ambulante Arztpraxen. Ansätze zum rationaleren Antibiotika-Gebrauch beziehen sich aber bisher eher auf die Krankenhäuser. Im ambulanten Bereich besteht ein großer Bedarf an innovativen Konzepten.
Zeigen sich bereits erste Erfolge von AnTiB?
AnTiB zieht Kreise. Das Konzept wurde lokal auf andere Fachrichtungen ausgeweitet – Hausärzte und Gynäkologen, Urologen und HNO-Ärzte, weitere Fachrichtungen sollen folgen. Wir beteiligen uns außerdem an überregionalen Absprachen und haben unser Bielefelder Konzept in vielen anderen Städten und bei Fachkongressen vorgestellt.
Konflikte treten jetzt im Praxisalltag kaum mehr auf. Inzwischen ist es Standard, die Patienten im Zweifelsfall noch einmal zur Kontrolle zu bestellen, statt „vorsorglich“ ein Antibiotikum zu verschreiben und das auch so zu kommunizieren. In Umfragen zeigte sich bei allen Kollegen eine große Zufriedenheit. Selbst von denen, die anfänglich eher skeptisch waren, kamen sehr positive Rückmeldungen.
Inwieweit auch die Antibiotika-Verordnungen reduziert wurden, wird bald eine wissenschaftliche Evaluation des Projektes durch die Fakultät für Gesundheitswissenschaften der Universität Bielefeld zeigen.[2]
Ihre ganz persönliche Erkenntnis aus dem Projekt?
In der Medizin brauchen wir viel mehr Kooperationsfähigkeit und Kooperationsbereitschaft. Dies ist nicht nur eine Voraussetzung für Projekte wie AnTiB, sie steigern genau solche Fähigkeiten auch.
Konzeption und Materialien von AnTiB werden Ärztinnen und Ärzten auch überregional zur Anwendung zur Verfügung gestellt. Weitere Informationen: www.antib.de, Kontakt: Diese E-Mail-Adresse ist vor Spambots geschützt! Zur Anzeige muss JavaScript eingeschaltet sein!
Foto Roland Tillmann © Susanne Freitag
Artikel aus dem Pharma-Brief 6/2019, S.6
[1] Informationen zu DART: www.bundesgesundheitsministerium.de/themen/praevention/antibiotika-resistenzen/antibiotika-resistenzstrategie.html
[2] Informationen zu AnTiB und der wissenschaftlichen Projektbegleitung durch die Fakultät für Gesundheitswissenschaften der Uni Bielefeld: www.antib.de
Die Geister von Genf
Transparenz bei Forschung weiter auf internationaler Agenda
Nach der viel diskutierten Kontroverse um Transparenz bei Arzneimittelpreisen auf der Weltgesundheitsversammlung im Mai in Genf hält die Debatte an. Im Vorfeld der nächsten UN Vollversammlung zeigen sich abermals alte Konfliktlinien. Welche Rolle wird Deutschland einnehmen?
„Nach dem Spiel ist vor dem Spiel“ – diese Sportlerweisheit gilt momentan auch in der Debatte um verbesserten Zugang zu medizinischer Behandlung. Zwar endete die letzte Weltgesundheitsversammlung in Genf beim Thema Transparenz-Resolution mit einem Paukenschlag und scharfer deutscher Kritik (wir berichteten[1]). Doch nehmen nachfolgende Prozesse den Faden direkt auf
Am 23. September findet in New York im Zuge der UN Vollversammlung das UN High-Level Meeting zu Universal Health Coverage (UHC) statt. Im sehr umfangreichen UHC-Resolutionsentwurf finden sich auch Aussagen zu Transparenz und Forschung. Ein Umstand, der angesichts der zurückliegenden Ereignisse in Genf gerade aus deutscher Perspektive beachtenswert ist.
Ein hartnäckiges Thema
Bis heute zieht sich die Bundesregierung auf den schwachen Einwand zurück, dass das damalige Prozedere bei der Transparenz-Resolution fehlerhaft gewesen sei und man sich deshalb distanziert habe.[2] Eine echte Auseinandersetzung mit der Tatsache, dass sich Deutschland vorher massiv für die Verwässerung und Beschneidung der Inhalte ins Zeug gelegt hatte, fand zumindest öffentlich nicht statt. Nun bildeten jedoch abermalige Debatten um Transparenz und Forschung eine der größten Hürden bei der Vorbereitung des Textes für New York.[3]
Gerungen wurde um mehrere Punkte, ein wichtiger war das Plädoyer für die Erhöhung der Transparenz bei Preisen und Forschungskosten. Hier hatte es bereits bei der Weltgesundheitsversammlung massive Konfrontationen zwischen Mitgliedsstaaten gegeben. Weitere umstrittene Ausführungen setzten sich für verbesserte Förderung alternativer Produktentwicklung ein. Zentral ist hier das Streben, den Produktpreis von den Kosten für Forschung und Entwicklung zu entkoppeln. „De-Linkage“, der verbreitete Begriff für diesen Ansatz, wurde jedoch offenbar absichtlich ausgespart, um Anstoß zu vermeiden. Ein später Entwurf enthielt zudem die Analyse, dass hohe Preise und schlechter Zugang Fortschritte bei UHC anhaltend beeinträchtigen. Auch diese Textstelle blieb umkämpft.[3]
New York ist nicht Genf – oder?
Universal Health Coverage ist ein vielschichtiges Thema, bei dem die Aspekte Transparenz und Forschung nur zwei von vielen sind. Allerdings können sie große Auswirkungen auf den Zugang zu angemessener Gesundheitsversorgung haben, gerade in ärmeren Ländern. So rechnet die WHO damit, dass allein in Afrika jedes Jahr elf Millionen Menschen durch Gesundheitsausgaben in die Armut rutschen.[4] Dabei geht es beispielsweise längst nicht nur um vernachlässigte Infektionskrankheiten, sondern auch verstärkt um nicht-übertragbare Krankheiten. Deutlich sichtbar ist dies etwa bei hochpreisigen Krebsmedikamenten.[5]
Die Bundesregierung wird im September voraussichtlich hochrangig in New York vertreten sein. In Genf hatte sich gezeigt, dass die öffentliche Aufmerksamkeit für die Themen Transparenz und Zugang groß ist und nationale Positionen kritisch, sowie mit Nachdruck hinterfragt werden. Es ist zu hoffen, dass die deutsche Politik daraus Schlüsse gezogen hat und diesmal eine konstruktivere Haltung einnehmen wird. (MK)
Artikel aus dem Pharma-Brief 4-5/2019, S.3
[1] Pharma Brief (2019) WHA: Deutschland auf Distanz zu Transparenz-Beschluss. Nr. 3. S. 1
[2] Dabei ist das Fundament dieser Kritik sehr fraglich. Denn Resolutionsentwürfe können nach WHO-Regularien bis zum ersten Tag der Weltgesundheitsversammlung eingebracht werden, wenn die Resolution auf der Agenda ist. Dies war bei der Transparenz-Resolution der Fall. Es ist zudem nirgendwo vorgegeben, dass Resolutionen zunächst beim Board eingebracht werden müssen, was ebenfalls ein deutscher Beschwerdepunkt war.
[3] Health Policy Watch (2019) Drug R&D, Sexual & Reproductive Health Scrutinised In Draft UHC Declaration. www.healthpolicy-watch.org/drug-rd-sexual-reproductive-health-scrutinised-in-draft-uhc-declaration/ [Zugriff 23.07.2019]
[4] DEVEX (2019) Achieving UHC in Africa requires support for most vulnerable, experts say www.devex.com/news/achieving-uhc-in-africa-requires-support-for-most-vulnerable-experts-say-94411 [Zugriff 24.07.2019]
[5] 't Hoen E et al. (2019) Improving affordability of new Essential Cancer Medicines. Lancet Oncol http://dx.doi.org/10.1016/S1470-2045(19)30459-0
Das Beste draus machen
Wie man negative Studienergebnisse kleinredet
„ ‘Alternative Fakten‘ zur Erklärung enttäuschend negativer Studienergebnisse?“ titelte Arzneimittelbrief.[1] Basis des Artikels war eine kleine Studie, die in der Weihnachtsausgabe des BMJ erschienen war.[2] Mit einer guten Prise britischen Humors gewürzt, beleuchtete sie das professionelle Schönreden von wissenschaftlichen Niederlagen.
Schon die Einleitung des BMJ-Artikels hat es in sich: „Der Fortschritt in der medizinischen Wissenschaft wird getrübt durch häufiges auf der Stelle treten, weil die meisten wundervollen Ideen am Ende nicht funktionieren. Um den Eindruck einer Flut von Entdeckungen und Begeisterung aufrechtzuerhalten, heuern Pharma- und Medizinproduktehersteller selektiv ExpertInnen ihres Fachs an, bei denen sie sich in allen Situationen auf eine ermutigende Darstellung verlassen können. Intern nennen die Firmen sie ‚Key Opinion Leader‘. Wir haben festgestellt: Wenn Key Opinion Leader enttäuschende Studienergebnisse in Nachrichtenportalen oder auf Konferenzen kommentieren sollen, scheinen sie merkwürdig unfähig zu erkennen, dass die Behandlung nicht funktioniert.“ Sie (er)finden zahlreiche Gründe, warum das Medikament doch besser sein könnte, als es die Studie ergab.
Da die sechs AutorInnen den Eindruck hatten, dass sich die Ausreden für die schlechten Ergebnisse häufig wiederholten, gingen sie die Sache systematisch an. Sie werteten Kommentare zu neuen Studien aus, die 2013-2017 auf drei großen Kardiolog-Innenkongressen in den USA und Europa vorgestellt worden waren. Die ForscherInnen fanden in den vielgelesenen Nachrichtenportalen „Medscape“ und „MedPage Today“ Kommentare zu 127 für den Sponsor unvorteilhaft ausgegangenen Studien.[3] In den allermeisten Fällen wurden die enttäuschenden Ergebnisse in Frage gestellt: In 108 der Berichte fanden sich Rechtfertigungen, warum das negative Ergebnis nicht aussagekräftig sei.
Die beliebteste Ausrede war, dass angeblich zu wenig PatientInnen in die Studie eingeschlossen waren, um ein statistisch signifikantes Ergebnis zu erzielen. Nur in einem von 39 Fällen machte sich der Key Opinion Leader aber die Mühe, die notwendige Anzahl vorzurechnen.
Die Ausrede „es sind weitere Studien notwendig“ (jede fünfte Negativstudie wurde damit kleingeredet) kommentieren die AutorInnen so: „Das legt nahe, dass der Key Opinion Leader die Ergebnisse einfach nicht mochte und wünscht, dass die Würfel erneut geworfen werden.“
Auch beliebt war die Behauptung, dass die PatientInnen zu krank waren (7 mal), um von der Behandlung noch profitieren zu können. Allerdings wurde bei elf Studien das negative Ergebnis mit dem genauen Gegenteil erklärt, dass die Krankheit zu mild oder in einem zu frühen Stadium war. Mal waren die Patientinnen nach dem Urteil der Propagandisten zu jung, mal zu alt, die Compliance war zu gut oder zu schlecht.
Mit typisch englischem Humor verfassten die AutorInnen am Schluss ein Drehbuch für die Key Opinion Leader. Ihr Motto: „Mit Hilfe des Drehbuchs ist keine Intervention zu ineffektiv, als dass sich nicht eine Ausrede dafür finden ließe.“ (JS)
Artikel aus dem Pharma-Brief 1/2019, S.5
[1] Der Arzneimittelbrief (2019) 53; S. 16DB01
[2] Hartley A et al. (2018) Key opinion leaders‘ guide to spinning a disappointing clinical trial result. BMJ; 363, p k5207
[3] Für den primären Endpunkt der Studie konnte kein signifikanter Unterschied zur Vergleichsbehandlung festgestellt werden.
Außer Kontrolle
Ebola-Epidemie im Kongo spitzt sich weiter zu
Ein Jahr nach dem Ausbruch einer Ebola-Epidemie im Osten der Demokratischen Republik Kongo ist die Seuche noch immer auf dem Vormarsch. In den betroffenen Gebieten steigt die Rate der Neuinfektionen – trotz massiver Bekämpfungsmaßnahmen. Wir sprachen mit dem Tropenmediziner Maximilian Gertler von Ärzte ohne Grenzen über Behandlungsprogramme, Präventionsarbeit und die Hintergründe der gegenwärtigen Lage.
Die WHO hat erst kürzlich kundgetan, dass es sich im Kongo nicht um einen internationalen Gesundheitsnotstand handelt. Wie beurteilen Sie die Lage vor Ort?
Dass kein internationaler Gesundheitsnotstand erklärt worden ist, finde ich zwar nachvollziehbar, weil die Epidemie bisher weitgehend auf eine Region begrenzt ist. Aber dass der Ausbruch nicht unter Kontrolle ist, ist offensichtlich. Er hat in absoluten Zahlen Ausmaße erreicht, die man bisher nur von der großen Epidemie in Westafrika vor 5 Jahren kannte: Über 2.000 Infizierte und über 1.500 Todesopfer seit Juni 2018. Man kriegt die Krankheit momentan nicht in den Griff – vor allem wegen der Konfliktsituation. Immer wieder gab es Angriffe auf Behandlungszentren und Helfer, z.B. in der Stadt Butembo.
Was sind die Gründe für diese Attacken?
Innerhalb der Bevölkerung herrscht ein großes Misstrauen gegenüber den Hilfsmaßnahmen. Eine im März im Lancet veröffentlichte Untersuchung hat gezeigt, dass über die Hälfte der Befragten glaubt, Ebola existiere nicht oder sei erfunden worden, um die Region zu destabilisieren. Es kursieren wilde Gerüchte über die Bekämpfungsmaßnahmen. Eine im März 2019 veröffentlichte Befragung von Translators without Borders zeigt, dass Poster, Broschüren und anderes Informationsmaterial vielfach nicht oder falsch verstanden werden. Vertrauen ist aber entscheidend für eine erfolgreiche Prävention und Prävention ist der Schlüssel zur Beendigung der Epidemie.
Woher rührt das mangelnde Vertrauen?
Die Bevölkerung fühlt sich vernachlässigt. Sie empfindet die staatliche Sorge um Ebola angesichts des jahrzehntelangen Konflikts als unglaubwürdig. Seit Jahren erfahren die Menschen unbeschreibbare Gewalt: Die ständige Angst vor Vertreibung, Überfällen, Vergewaltigung. Kinder, die für Söldnergruppen rekrutiert werden… Es sterben wegen der mangelhaften medizinischen Versorgung sehr viele Menschen auch an anderen Krankheiten. Neben all diesem Leid hat Ebola für die Menschen im Ost-Kongo eine untergeordnete Bedeutung.
Gegen Ebola gibt es inzwischen einen Impfstoff, der in Kanada mit öffentlichen Geldern erforscht, an ein kleines Pharmaunternehmen auslizensiert und 2014 während des Ebola-Ausbruchs in Westafrika von der US-Firma Merck aufgekauft wurde. Noch immer ist das Mittel nicht zugelassen und wird unter Studienbedingungen eingesetzt. Wie gut ist dieser Impfstoff verfügbar?
Nur eine Woche, nachdem der Ebola-Ausbruch im Kongo bestätigt wurde, stand der Impfstoff zur Verfügung. Er ist offenbar sehr gut wirksam und gut verträglich. Ärzte ohne Grenzen hat Impfteams ausgebildet und in die Regionen geschickt. Im Rahmen von Ring-Impfkampagnen wurden zunächst alle Gesundheitshelfer, dann alle Kontaktpersonen von Infizierten und schließlich die Kontakte der Kontaktpersonen geimpft. Bis jetzt wurden mehr als 136.000 Menschen im Ost-Kongo unter Führung der WHO und des nationalen Gesundheitsministeriums geimpft. Ich kann nicht sagen, wieviel Impfstoff in der Region noch verfügbar ist. Merck hat weitere Lieferungen angekündigt, und gegenwärtig erklärt die WHO die Möglichkeit, mit reduzierten Impfdosen zu arbeiten.
Was geschieht, wenn der Impfstoff zur Neige geht?
Die WHO hat erklärt, dass die Impfstoffdosis bei Kontaktpersonen auf die Hälfte und bei den Kontaktpersonen der Kontaktpersonen auf ein Fünftel reduziert werden kann, um so mehr Menschen mit dem vorhandenen Vorrat impfen zu können. Das kongolesische Gesundheitsministerium ist außerdem dabei, weitere Optionen zu prüfen – gemeinsam mit der WHO, der London School of Hygiene & Tropical Medicine und uns. Dabei geht es zum Beispiel um den möglichen Einsatz eines zweiten Impfstoffs von Johnson & Johnson, der sich derzeit in klinischen Studien der Phase 3 befindet. Von diesem Impfstoff sollen in absehbarer Zeit 1,5 Millionen Impfdosen zur Verfügung stehen. Damit könnten dann nicht mehr nur unmittelbar betroffene Personen, sondern ganze Regionen durchgeimpft werden.
Aufgrund der Angriffe musste Ärzte ohne Grenzen seine Behandlungszentren im Ost-Kongo schließen. Wie geht es jetzt weiter?
In Butembo und Katwa, den noch vor Wochen am stärksten betroffenen Gebieten, sind die Strukturen, die wir hatten, zerstört. Isolierstationen betreiben wir nur noch in anderen Regionen. Aber wir unterstützen weiterhin vor allem die epidemiologische Arbeit, Impfmaßnahmen und Aufklärungskampagnen. Unser Fokus liegt darauf, die vorhandenen Gesundheitsstrukturen im Kampf gegen Ebola zu stärken. Man muss den Menschen dort helfen, wo sie sind. Schließlich ereignet sich etwa die Hälfte der Todesfälle in den Dörfern und Familien und nicht auf den Isolierstationen. Und es geht nicht nur um Ebola – es geht um die Gesundheit der Bevölkerung insgesamt.
Artikel aus dem Pharma-Brief 3/2019, S.3
Antibiotikaresistenzen in NRW-Gewässern
BUND fordert Konsequenzen
Die Naturschutzorganisation BUND hat in Flüssen und Seen in NRW nach resistenten Keimen gesucht – und wurde fündig. Paul Kröfges, Gewässerexperte des BUND NRW, berichtet.
Nachdem der NDR Anfang 2018 antibiotikaresistente Bakterien (ARB) in mehreren Gewässern Niedersachsens nachgewiesen hatte, stellte sich die Frage nach der Situation in anderen Bundesländern. In Nordrhein-Westfalen wiegelte das zuständige Umweltministerium ab und verwies auf ein länger laufendes Forschungsprojekt (HyReKA),[1] dessen Ergebnisse man abwarten wolle.
Daraufhin beauftragte der BUND NRW im April und Juli 2018 die Medizinische Fakultät der Ruhr Universität Bochum mit der Untersuchung von 13 Gewässerproben aus NRW nach einem anerkannten Verfahren.[2] Es handelte sich dabei um 5 Proben aus landwirtschaftlich geprägten Gewässerstrecken im Kreis Borken, einer Probe aus einem Badesee bei Viersen und weiteren 7 Proben aus Gewässern in NRW, die unterschiedliche Einflüsse aus Kläranlagen aufweisen.[3]
Untersuchungen 2018
In den landwirtschaftlich beeinflussten Proben wurden bis zu 7 Resistenzen gegenüber 14 getesteten Antibiotika festgestellt. Dies sind deutliche Hinweise auf den Einsatz von Antibiotika in der dort praktizierten Tierhaltung und der Resistenzverbreitung über die Ausbringung belasteter Gülle.
In der Probe aus einem Badesee bei Viersen wurden Colibakterien mit medizinisch relevanter Multiresistenz gegen 3 Reserveantibiotika nachgewiesen (3 MRGN). Als Ursachen kommen sowohl Einträge durch Zuflüsse von landwirtschaftlichen Flächen als auch durch Badende in Frage.
Problematisch sind auch die Ergebnisse aus Nette, Sieg und Agger. So wurden in einem Abschnitt der Nette, vor der Kläranlage Viersen-Dülken, hohe Anteile an multiresistenten Colibakterien gefunden (3 MRGN). Ursache dafür könnte der Überlauf von Mischwasser aus dem überlasteten Kanalnetz [4] oder auch eine nahegelegene große Schweinemastanlage sein.
Auffallend war die Belastung hinter Kläranlagen mit angeschlossenen Krankenhäusern. So lagen hinter der Kläranlage Rosbach (ohne Klinik) in der Sieg nur relativ geringe Belastungen vor. Dagegen wurden weiter flussabwärts, etwa 2 km hinter der Kläranlage Eitorf, die Abwässer eines Krankenhauses aufnimmt, resistente Bakterien der Kategorie 3 MRGN festgestellt. Zwischen dem Ablauf der Kläranlage und der Probenentnahmestelle liegt ein Campingplatz mit großem Badebetrieb bei sommerlichen Temperaturen.
Als noch problematischer erwies sich die Situation an der Agger, einem Nebengewässer der Sieg. Dort wurden hinter der Kläranlage Engelskirchen, an die 2 größere Kliniken angeschlossen sind, in einer Probe vom 10. Juli 2018 sogar 4 MRGN (E-Coli) Bakterien nachgewiesen.
Hier ist die Situation des Gewässers besonders problematisch, da die Einleitung der Kläranlage in das alte Aggerbett bei Ehreshoven erfolgt. Das Flüsschen hat eine Mindestwasserführung von nur 500 Litern Wasser pro Sekunde, während der weitaus größere Wasseranteil nebenan kanalisiert in die Turbinen der Aggerkraftwerke geleitet wird. Der Rest im ehemaligen natürlichen Flussbett muss mit dem keim- und spurenstoffbelasteten Abwasserstrom fertig werden. Unter diesen Bedingungen können sich unterhalb des Kläranlagenablaufes antibiotikaresistente Bakterien vermehren, u.U. sogar regelrecht gezüchtet werden, so die Befürchtung des BUND.
Untersuchungen 2019
Da der zuständige Wasserverband keine aktuellen Messwerte von Arzneimitteln, insbesondere Antibiotika, vorlegen konnte, wurde der BUND erneut aktiv. Er ließ im März und April 2019 zwei Proben aus dem Ablauf der Kläranlage Engelskirchen auf 42 Komponenten aus diesem Spektrum untersuchen.
Die Ergebnisse belegen nach Einschätzung des BUND eine deutliche Belastung der Agger mit Rückständen von Antibiotika, Blutdrucksenkern, Epilepsie-, Herz- und Kreislaufmitteln verschiedenster Art durch die Kläranlage Engelskirchen.
Konsequenzen und Forderungen
Der BUND forderte bereits 2018 die Behörden auf, mit einem Untersuchungsprogramm, die Eintragspfade von Arzneiwirkstoffen und antibiotikaresistenten Bakterien in die Agger aufzuklären, vor allem den Einfluss der an die Kläranlage angeschlossenen Kliniken. Ziel sollten sinnvolle und wirksame Maßnahmen zur Verringerung der Belastung sein. Obwohl nicht als Badegewässer ausgewiesen, wird auch die Agger zur Naherholung, zum Angeln und auch zur gelegentlichen Erfrischung an heißen Sommertagen genutzt – und gerade dann ist die Gefahr von Infektionen oder der Übertragung solcher Keime auf andere Menschen hoch. Die vom Umweltministerium angekündigten NRW-weiten Untersuchungen hält der BUND für wichtig, aber nicht ausreichend. Diese geben nur einen groben Überblick über die landesweite Problematik und können im konkreten Fall nur bedingt weiterhelfen.
In der Zwischenzeit fand ein Gespräch des BUND mit der Leitung des für die Unterhaltung der Agger und die Kläranlage Engelskirchen zuständigen Aggerverbandes statt. Hierbei wurden die BUND-Ergebnisse durch frühere, vom Verband veranlasste, Untersuchungen bestätigt. Allerdings hatte der Verband nicht nach Antibiotika gesucht.
Auch die Problematik der Resistenzbildung im Gewässern nimmt der Verband ernst, will aber kein „kostspieliges“ Sondermessprogramm auflegen, sondern aktiv das aktuell anlaufende Messprogramm des Landes unterstützen. Hierbei werden nach Aussagen des Landes die BUND Messstellen einbezogen. Aggerverband und BUND haben sich darauf verständigt, auf Basis dieser Ergebnisse dann über Konsequenzen und weitere Maßnahmen zu beraten. (Paul Kröfges)
Artikel aus dem Pharma-Brief 3/2019, S.6
Bild © BUND NRW
[2] Dabei werden nach Vorgaben der Kommission für Krankenhaushygiene und Infektionsprävention beim Robert Koch Institut bis zu 19 Antibiotika, variiert je nach festgestellter Bakterienart, getestet
[3] Alle Ergebnisse: www.bund-nrw.de/presse/detail/news/bund-weist-multiresistente-keime-in-gewaessern-nach
[4] Abwasserkanäle, in denen Schmutzwasser und Regenwasser gemeinsam ins Klärwerk fließen
Antibiotika-Resistenzen
Neues Projekt beleuchtet länderspezifische Facetten
Resistente Erreger verbreiten sich rund um den Globus. Bei Armutskrankheiten wie Tuberkulose und nicht zuletzt im Bereich der Mutter-Kind-Gesundheit sorgen sie für massive Behandlungsprobleme, eine Explosion der Gesundheitskosten und hohe Sterberaten. Die BUKO Pharma-Kampagne plant zahlreiche Aktivitäten, um dieser Thematik mehr öffentliche Aufmerksamkeit zu verschaffen.
Das drohende Zukunftsszenario eines post-antibiotischen Zeitalters bezeichnete die WHO schon 2015 als „globale Gesundheitskrise“. Die Folgen sind verheerend, vor allem in armen Ländern. Einerseits leiden Menschen, denen es an guten Lebensbedingungen, sauberem Trinkwasser oder sanitärer Versorgung mangelt, wesentlich häufiger unter Infektionen. Andererseits sind Therapien gegen resistente Erreger oft nicht verfügbar oder unbezahlbar. Zudem greifen PatientInnen, die für eine ärztliche Beratung selbst aufkommen oder dafür beschwerliche Wege auf sich nehmen müssen, häufig ohne Diagnose zu Antibiotika. Das gilt besonders, wenn diese Mittel rezeptfrei und billig zu haben sind. Der übermäßige und unsachgemäße Gebrauch von Antibiotika beschleunigt wiederum die Resistenz-Entwicklung erheblich.
Das Beispiel Gonorrhö
Antibiotika-Resistenzen (ABR) führen dazu, dass bisher leicht therapierbare Erkrankungen plötzlich unbeherrschbar werden. Ein Blick auf das Beispiel Gonorrhö verdeutlicht die dramatische Situation: Mit 78 Millionen Erkrankungen jährlich ist sie weltweit die zweithäufigste sexuell übertragbare Erkrankung. Die höchsten Infektionsraten verzeichnet der afrikanische Kontinent. Die von der Krankheit hervorgerufenen Entzündungen können besonders für Frauen gefährliche Konsequenzen haben, zudem erhöhen sie das Risiko einer HIV-Infektion. Resistente Erregerstämme machen die Behandlung von Gonorrhö vielerorts inzwischen nahezu unmöglich.[1] In Großbritannien sorgte im März 2018 ein Fall für Aufsehen, der erstmalig Resistenzen gegen beide Antibiotika der Standard-Behandlung aufwies. Die Ansteckung war in Südostasien erfolgt.[2]
Steigender Verbrauch ein Problem
Der Verbrauch von Antibiotika steigt weltweit kontinuierlich an. Eine 2018 veröffentlichte Studie stellte fest, dass der Verkauf zwischen 2000 und 2015 um rund 65% zugenommen hat. In Ländern geringen und mittleren Einkommens gab es einen Anstieg um 114%. Indien stach dabei besonders hervor.[3] In Deutschland zeigen Analysen der Krankenkassen, dass Antibiotika auch bei uns häufig falsch und unnötig verordnet werden.[4],[5]
Eine zentrale Rolle bei der Entwicklung resistenter Keime spielt auch die Landwirtschaft. Der massive Einsatz von Antibiotika bei der Tiermast bringt längst auch Reservepräparate an den Rand ihrer Wirksamkeit. 2015 sorgte der Fund eines neuen Resistenz-Gens bei Schweinen und Hühnern in China für Entsetzen. Selbst Colistin, ein wichtiges Mittel der letzten Reserve, wirkte bei Tieren und Menschen nicht mehr. Nur ein Jahr später wurde das leicht zwischen Bakterien übertragbare Gen auch in Deutschland und anderen europäischen Staaten bei Patienten nachgewiesen.[6],[7]
Weil die Nachfrage nach billigem Fleisch kontinuierlich steigt, nimmt die Massentierhaltung in armen Ländern rasant zu. Die hochgezüchteten Rassen sind jedoch selten an die klimatischen Bedingungen in Südländern angepasst. Die Tiere erkranken öfter und werden häufiger mit Antibiotika behandelt. Auch als Masthilfe bzw. Wachstumsbeschleuniger werden Antibiotika eingesetzt. Die dadurch entstehenden Resistenzen werden durch die Import- und Export-Beziehungen im Fleischhandel globalisiert.
Resistente Keime in Flüssen
Nicht zuletzt birgt die Herstellung von Antibiotika, die oft in Indien und anderen Ländern des globalen Südens erfolgt, gravierende Probleme mit sich. Ende 2017 stieß ein Team deutscher Journalisten bei Wasserproben in Hyderabad/Indien, woher auch fast alle großen deutschen Pharmahersteller Antibiotika beziehen, auf extrem hohe Konzentrationen antibiotischer Wirkstoffe in Gewässern sowie im Grund- und Trinkwasser (Pharma-Brief 5-6, 2017, S. 1.) Die so befeuerte Entwicklung von Resistenzen stellt nicht nur ein lokales Gesundheitsrisiko dar. Denn resistente Erreger kennen keine Grenzen und breiten sich z.B. durch Tourismus weltweit aus. Eine Leipziger Studie fand bei über 70 Prozent der Indien-Reisenden nach ihrer Rückkehr resistente Erreger. Bei Rückkehrenden aus Südostasien waren es fast 50 Prozent.[8]
In jüngster Zeit sind Antibiotika-resistente Erreger in deutschen Gewässern und Badeseen in den Fokus gerückt. Im Februar 2018 fand sich bei Wassertests an verschiedenen Bächen und Seen Niedersachsens eine Vielzahl resistenter Erreger. (Der Pharma-Brief berichtete, 2/2018, S. 2) Antibiotische Wirkstoffe aus der Tierhaltung sind dafür maßgeblich verantwortlich. Sie gelangen u.a. über die ausgebrachte Gülle in Boden und Gewässer. Aber auch Abwässer aus Krankenhäusern und Pflegeheimen weisen hohe Konzentrationen antibiotischer Rückstände auf. Die Kläranlagen sind derzeit technisch nicht dafür ausgerüstet, solche Rückstände von Medikamenten aus dem Wasser herauszufiltern.
Was tut die Pharma-Kampagne?
Die BUKO Pharma-Kampagne nimmt die globale Resistenz-Problematik mit einem neuen Projekt unter die Lupe: Unter dem Titel „Antibiotika-Resistenzen in Nord und Süd - Globale Herausforderungen erkennen, lokale Handlungsoptionen fördern“ werden wir gemeinsam mit Partnerorganisationen in Indien, Tansania und Südafrika eine Datenerhebung durchführen. Im Frühsommer 2020 wollen wir die Ergebnisse und Analysen in einer Broschüre veröffentlichen und dabei auch auf die Situation in Deutschland Bezug nehmen.
Außerdem soll eine Wanderausstellung die komplexe Problematik ansprechend und authentisch vermitteln. Großformatige Bildtafeln, interessante Texte und multimediale Elemente sollen die Resistenzprobleme in verschiedensten Teilen der Welt abbilden, Ursachen aufzeigen und lokale Lösungsstrategien und Handlungsansätze vorstellen. Die Ausstellung wird sich an kritische VerbraucherInnen sowie Beschäftigte in der Landwirtschaft und im Gesundheitswesen richten und soll ab Sommer 2020 im Rahmen von Messen, Kongressen und Veranstaltungen gezeigt werden.
Zusätzlich ist im kommenden Jahr eine zweiwöchige bundesweite Theatertournee geplant, die die Inhalte der Ausstellung aufgreift. So wollen wir der Thematik eine möglichst breite Öffentlichkeit verschaffen, zur politischen Meinungsbildung beitragen und zugleich kommende Ausstellungstermine effektvoll bewerben. Nicht zuletzt sollen ein großes Symposium (2021), gezielte Advocacy- und Öffentlichkeitsarbeit sowie interdisziplinäre Fachgespräche die Probleme bekannter machen und zu einer Vermeidung von Antibiotika-Resistenzen sowie zu entsprechenden gesellschaftlichen Veränderungen in Deutschland beitragen. Das von der Nordrhein-Westfälischen Stiftung Umwelt und Entwicklung geförderte Projekt startete im Juni 2019, Aktivitäten sind bis Ende 2021 geplant.
Artikel aus dem Pharma-Brief 3/2019, S.5
[1] WHO (2017) Antibiotic-resistant gonorrhoea on the rise, new drugs needed. Meldung vom 7.Juli www.who.int/news-room/detail/07-07-2017-antibiotic-resistant-gonorrhoea-on-the-rise-new-drugs-needed [Zugriff 24.6.19]
[2] Gallagher J (2018) ‚World‘s worst‘ super-gonorrhoea man cured. BBC news v. 20.April www.bbc.com/news/health-43840505 [Zugriff 24.6.19]
[3] Klein EY et al. (2018) Global increase and geographic convergence in antibiotic consumption between 2000 and 2015.PNAS; 115, p E3463 https://doi.org/10.1073/pnas.1717295115
[4] Ärzteblatt (2016) BKK-Studie: Ärzte verschreiben Antibiotika oft auf Verdacht. 5.August www.aerzteblatt.de/nachrichten/69907/BKK-Studie-Aerzte-verschreiben-Antibiotika-oft-auf-Verdacht [Zugriff 24.6.19]
[5] TK (2018) Berliner Ärzte verschreiben am seltensten Antibiotika bei Erkältungen. Pressemitteilung vom 15. Oktober www.tk.de/presse/themen/arzneimittel/antibiotika-2044926 [Zugriff 24.6.19]
[6] RKI (2016) Colistin-Resistenz bei Gram-negativen Bakterien – die Situation in Deutschland. Epidemiologisches Bulletin. S. 513
[7] Reardon S (2017) Resistance to last-ditch antibiotic has spread farther than anticipated. Nature, 12.6. www.nature.com/news/resistance-to-last-ditch-antibiotic-has-spread-farther-than-anticipated-1.22140 [Zugriff 24.6.19]
[8] Lübbert C et al. (2015) Coloni Colonization with extended-spectrum beta-lactamase-producing and carbapenemase-producing Enterobacteriaceae in international travelers returning to Germany. International Journal of Medical Microbiology; 305, p 148 https://doi.org/10.1016/j.ijmm.2014.12.001