Pharma-Brief 6/2021: über Patente und unsere neuen Projekte

Der Pharma-Brief 6/2021 beschäftigt sich mit folgenden Themen:
Patente sind auch keine Lösung
Warum wir andere Wege gehen müssen, um Forschung zu finanzieren
„Ohne Patente kein medizinischer Fortschritt“ – gerade in der Diskussion um den Patent-Waiver bei der Welthandelsorganisation wird Big Pharma nicht müde, dieses Argument zu wiederholen. Doch nicht nur hohe Arzneimittelpreise, die für große Teile der Weltbevölkerung unbezahlbar sind und fehlende Forschung für vernachlässigte Krankheiten strafen dieses Mantra Lügen. Auch die Tatsache, dass die entscheidende Grundlagenforschung vorwiegend öffentlich finanziert wird, macht ein Umdenken notwendig und wirtschaftlich attraktiv. Weiterlesen
USA: Zulassung ohne Evidenz
Alzheimer-Medikament trotz Kritik zugelassen
Das Alzheimer-Mittel Aducanumab wurde in den USA im Juni 2021 trotz scharfer Proteste von WissenschaftlerInnen1 zugelassen. Eine fragwürdige Entscheidung mit gleich mehreren negativen Folgen. Weiterlesen
Großbaustelle globale Arzneimittelversorgung
Ein neues Bildungsprojekt der Pharma-Kampagne
Mit Problemen und Fallstricken beim global gerechten Zugang zu Arzneimitteln beschäftigt sich ein neues Projekt der Pharma-Kampagne, das vom Bundesministerium für wirtschaftliche Zusammenarbeit und Entwicklung (BMZ) gefördert wird. Im Rahmen einer Online-Seminarreihe soll umfangreiches Fachwissen an entwicklungspolitische Akteure vermittelt werden. Weiterlesen
Peru – Tödliche Folgen eines maroden Systems
Covid-19 offenbart Schwachpunkte der Versorgung
Covid-19 hat Peru schwer getroffen. Nirgendwo sonst ist die Sterberate so hoch: Bis Mitte Juli wurden in dem südamerikanischen Land fast 200.000 Todesfälle verzeichnet – bei rund 33 Millionen EinwohnerInnen. Es fehlt an ÄrztInnen, Intensivbetten und Sauerstoff. Andere Erkrankungen wie Malaria, die vor allem in der Amazonasregion endemisch ist, scheinen im Schatten der Pandemie zu verschwinden. Weiterlesen
Aus aller Welt
- Moderna: Dreifach absahnen
- USA: Hohe Preise wegen Profit
- Pfizer zahlt wegen überhöhter US-Preise
- Lediant: Strafe für Preistreiberei in NL
- WTO: „Waiver“-Streit spitzt sich zu
Download: Pharma-Brief 6/2021 [PDF/455kB]
Bild © Ministerio de Defensa del Perú
Außer Kontrolle
Ebola-Epidemie im Kongo spitzt sich weiter zu
Ein Jahr nach dem Ausbruch einer Ebola-Epidemie im Osten der Demokratischen Republik Kongo ist die Seuche noch immer auf dem Vormarsch. In den betroffenen Gebieten steigt die Rate der Neuinfektionen – trotz massiver Bekämpfungsmaßnahmen. Wir sprachen mit dem Tropenmediziner Maximilian Gertler von Ärzte ohne Grenzen über Behandlungsprogramme, Präventionsarbeit und die Hintergründe der gegenwärtigen Lage.
Die WHO hat erst kürzlich kundgetan, dass es sich im Kongo nicht um einen internationalen Gesundheitsnotstand handelt. Wie beurteilen Sie die Lage vor Ort?
Dass kein internationaler Gesundheitsnotstand erklärt worden ist, finde ich zwar nachvollziehbar, weil die Epidemie bisher weitgehend auf eine Region begrenzt ist. Aber dass der Ausbruch nicht unter Kontrolle ist, ist offensichtlich. Er hat in absoluten Zahlen Ausmaße erreicht, die man bisher nur von der großen Epidemie in Westafrika vor 5 Jahren kannte: Über 2.000 Infizierte und über 1.500 Todesopfer seit Juni 2018. Man kriegt die Krankheit momentan nicht in den Griff – vor allem wegen der Konfliktsituation. Immer wieder gab es Angriffe auf Behandlungszentren und Helfer, z.B. in der Stadt Butembo.
Was sind die Gründe für diese Attacken?
Innerhalb der Bevölkerung herrscht ein großes Misstrauen gegenüber den Hilfsmaßnahmen. Eine im März im Lancet veröffentlichte Untersuchung hat gezeigt, dass über die Hälfte der Befragten glaubt, Ebola existiere nicht oder sei erfunden worden, um die Region zu destabilisieren. Es kursieren wilde Gerüchte über die Bekämpfungsmaßnahmen. Eine im März 2019 veröffentlichte Befragung von Translators without Borders zeigt, dass Poster, Broschüren und anderes Informationsmaterial vielfach nicht oder falsch verstanden werden. Vertrauen ist aber entscheidend für eine erfolgreiche Prävention und Prävention ist der Schlüssel zur Beendigung der Epidemie.
Woher rührt das mangelnde Vertrauen?
Die Bevölkerung fühlt sich vernachlässigt. Sie empfindet die staatliche Sorge um Ebola angesichts des jahrzehntelangen Konflikts als unglaubwürdig. Seit Jahren erfahren die Menschen unbeschreibbare Gewalt: Die ständige Angst vor Vertreibung, Überfällen, Vergewaltigung. Kinder, die für Söldnergruppen rekrutiert werden… Es sterben wegen der mangelhaften medizinischen Versorgung sehr viele Menschen auch an anderen Krankheiten. Neben all diesem Leid hat Ebola für die Menschen im Ost-Kongo eine untergeordnete Bedeutung.
Gegen Ebola gibt es inzwischen einen Impfstoff, der in Kanada mit öffentlichen Geldern erforscht, an ein kleines Pharmaunternehmen auslizensiert und 2014 während des Ebola-Ausbruchs in Westafrika von der US-Firma Merck aufgekauft wurde. Noch immer ist das Mittel nicht zugelassen und wird unter Studienbedingungen eingesetzt. Wie gut ist dieser Impfstoff verfügbar?
Nur eine Woche, nachdem der Ebola-Ausbruch im Kongo bestätigt wurde, stand der Impfstoff zur Verfügung. Er ist offenbar sehr gut wirksam und gut verträglich. Ärzte ohne Grenzen hat Impfteams ausgebildet und in die Regionen geschickt. Im Rahmen von Ring-Impfkampagnen wurden zunächst alle Gesundheitshelfer, dann alle Kontaktpersonen von Infizierten und schließlich die Kontakte der Kontaktpersonen geimpft. Bis jetzt wurden mehr als 136.000 Menschen im Ost-Kongo unter Führung der WHO und des nationalen Gesundheitsministeriums geimpft. Ich kann nicht sagen, wieviel Impfstoff in der Region noch verfügbar ist. Merck hat weitere Lieferungen angekündigt, und gegenwärtig erklärt die WHO die Möglichkeit, mit reduzierten Impfdosen zu arbeiten.
Was geschieht, wenn der Impfstoff zur Neige geht?
Die WHO hat erklärt, dass die Impfstoffdosis bei Kontaktpersonen auf die Hälfte und bei den Kontaktpersonen der Kontaktpersonen auf ein Fünftel reduziert werden kann, um so mehr Menschen mit dem vorhandenen Vorrat impfen zu können. Das kongolesische Gesundheitsministerium ist außerdem dabei, weitere Optionen zu prüfen – gemeinsam mit der WHO, der London School of Hygiene & Tropical Medicine und uns. Dabei geht es zum Beispiel um den möglichen Einsatz eines zweiten Impfstoffs von Johnson & Johnson, der sich derzeit in klinischen Studien der Phase 3 befindet. Von diesem Impfstoff sollen in absehbarer Zeit 1,5 Millionen Impfdosen zur Verfügung stehen. Damit könnten dann nicht mehr nur unmittelbar betroffene Personen, sondern ganze Regionen durchgeimpft werden.
Aufgrund der Angriffe musste Ärzte ohne Grenzen seine Behandlungszentren im Ost-Kongo schließen. Wie geht es jetzt weiter?
In Butembo und Katwa, den noch vor Wochen am stärksten betroffenen Gebieten, sind die Strukturen, die wir hatten, zerstört. Isolierstationen betreiben wir nur noch in anderen Regionen. Aber wir unterstützen weiterhin vor allem die epidemiologische Arbeit, Impfmaßnahmen und Aufklärungskampagnen. Unser Fokus liegt darauf, die vorhandenen Gesundheitsstrukturen im Kampf gegen Ebola zu stärken. Man muss den Menschen dort helfen, wo sie sind. Schließlich ereignet sich etwa die Hälfte der Todesfälle in den Dörfern und Familien und nicht auf den Isolierstationen. Und es geht nicht nur um Ebola – es geht um die Gesundheit der Bevölkerung insgesamt.
Artikel aus dem Pharma-Brief 3/2019, S.3
WHA: Deutschland auf Distanz zu Transparenz-Beschluss
Bundesregierung verteidigt undurchsichtige Strukturen im Pharma-Markt
Die Geheimniskrämerei bei Medikamentenpreisen und klinischen Studien schadet PatientInnen weltweit. Sie behindert einen fairen Zugang zu Arzneimitteln ebenso wie den Zugang zu verlässlichen Informationen. Am 28. Mai hat die Weltgesundheitsversammlung (WHA) eine Resolution angenommen, die dem entgegenwirken möchte. Der deutlich ambitioniertere, ursprüngliche Entwurf ist jedoch massiv aufgeweicht worden. Deutschland blockierte besonders energisch und übte heftige Kritik am Verfahren.
Ein Schritt in die richtige Richtung – so sahen es Viele nach Abschluss des tagelangen Ringens in Genf. WHO-Generaldirektor Dr. Thedros Adhanom Gheyebresus sprach von einem Meilenstein.[1] Vor allem Länder und zivilgesellschaftliche Organisationen des globalen Südens aber auch beachtlich viele aus dem Norden hatten schon früh Unterstützung für die Initiative signalisiert.
Die Resolution, ursprünglich von Italien eingebracht, umfasst mehrere Handlungsfelder.[2] Beispielsweise sollen die tatsächlich gezahlten Medikamentenpreise weltweit bekannt gemacht werden. Bislang sind die mit einzelnen Ländern ausgehandelten Rabatte meist geheim. Außerdem soll öffentlich werden, wo die Hersteller für neue hochpreisige Medikamente gar keine nationale Zulassung beantragen, weil der Markt zu wenig Profit verspricht. Auch die Ergebnisse von klinischen Studien sollen ausnahmslos veröffentlicht werden. Nicht zuletzt will die Resolution für mehr Transparenz bei Forschungskosten und -finanzierung sorgen. Allerdings wurde der Ursprungstext gerade bei diesem Thema stark verwässert. In der verabschiedeten Fassung heißt es daher nur noch: „Die 72. Weltgesundheitsversammlung […] stellt die Wichtigkeit der Finanzierung der Forschung und Entwicklung von Gesundheitsprodukten durch den öffentlichen wie privaten Sektor fest, und sucht die Transparenz dieser Finanzierung entlang der Wertschöpfungskette zu verbessern.“[2]
Deutsche Delegation rügt Verfahren
Deutschland war in Genf ein echter Bremsklotz bei der Suche nach ambitionierteren Lösungen. Zunächst beschwerte sich die Delegation über Prozessmängel, da das italienische Gesundheitsministerium die Resolution erst einen Tag nach Sitzung des WHO-Exekutivrates eingereicht hatte. Das Gremium beriet entsprechend nicht über den Text, was unüblich ist, aber in der Vergangenheit durchaus schon vorkam. Zudem wurde der fast viermonatige Vorlauf als zu geringer Zeitrahmen kritisiert.
Zu einem „echten diplomatischen Thriller“ (so der Lancet) waren die Verhandlungen spätestens geworden, als das WHO-Sekretariat versehentlich einen Entwurf mit nationalen Änderungswünschen unabgestimmt veröffentlichte, der natürlich schnell von Medien und NGOs verbreitet wurde.[3] Spätere Änderungen im Resolutionstext waren mit Beginn der WHA dann ohnehin öffentlich. So lässt sich nachverfolgen, dass Deutschland, ungeachtet seines Protests gegen das Verfahren, in den inoffiziellen wie formellen Verhandlungen umfangreiche Umformulierungen und Streichungen einbrachte, um progressive Forderungen zu entkernen oder komplett zu tilgen.[4] Gegen Ende blieb die Delegation dann den Verhandlungen fern und stand schließlich mit Ungarn und Großbritannien allein auf weiter Flur, als die drei Länder sich in einem ungewöhnlichen Schritt entschlossen, offiziell auf Distanz zur finalen Version zu gehen.[5]
Subventionen weiter geheim?
Dass ausgerechnet Deutschland sich derart in die Bresche wirft, um den pharmafreundlichen Status Quo zu wahren, ist erschreckend. Schließlich hat sich die Bundesregierung deutlich zu ihrer Verantwortung im Bereich globale Gesundheit bekannt, beansprucht hier eine Führungsrolle und hat in den letzten Jahren durchaus auch begrüßenswerte Initiativen auf den Weg gebracht hat. Die eingebrachten Änderungswünsche in der aktuellen WHA-Resolution sprechen jedoch eine deutlich andere Sprache.
So torpedierten die Deutschen Bemühungen, die Forschungskosten der Pharma-Hersteller und deren Preisgestaltung transparenter zu machen. Sogar die in den Forschungskosten enthaltenen öffentlichen Zuschüsse und Subventionen sollten nicht aufgedeckt werden. Zum Vergleich: Spanien ging der verabschiedete Resolutionstext beim Thema Forschungskosten nicht weit genug. Außerdem wandte sich Deutschland gegen das Bestreben, mehr Licht in das Patentdickicht zu bringen, um etwa Anfechtungen von fragwürdigen Patenten (Patentopposition) oder Zwangslizenzen zu vereinfachen.
Der breiten Kritik aus der politischen Opposition in Deutschland begegnete das Bundesministerium für Gesundheit mit Unverständnis, wie das Ärzteblatt schreibt: „Die Arzneimittelpreise in Deutschland seien transparent, hieß es vom Ministerium. Allerdings erkenne man die Arzneimittelrabatte, die zwischen Industrie und Krankenkassen ausgehandelt würden, als Geschäftsgeheimnisse an.“[6]
Kritik an der Kritik
Auf der Ziellinie des WHA-Verhandlungsmarathons stand neben den Inhalten der Resolution auch Verfahrenskritik im Vordergrund. Abseits von Deutschland rügten auch andere Staaten wie Australien und Schweden den untypischen Prozess, primär die als zu kurz wahrgenommene Dauer, sowie das Fehlen einer Debatte im Exekutivrat. Brasilien und Spanien widersprachen dieser Auffassung wiederum, nannten den Prozess fair und die Zeit ausreichend.
Die deutsche Seite hingegen sah gar eine „Verletzung des Geistes von Genf“. [7] Sie erhob den Vorwurf, es habe Versuche gegeben, Delegationen „öffentlich einzuschüchtern“. Dabei habe „man unzutreffende Informationen über die Gründe für diese Positionen durchsickern lassen.“[8]
Ellen 't Hoen, Direktorin von Medicines Law & Policy und früher unter anderem aktiv für Health Action International und den Medicines Patent Pool, war in Genf vor Ort und widerspricht dieser Leseart: „Deutschland war von Tag 1 an gegen diese Resolution. Nun verwechselt es demokratische Prozesse, in denen politisch Handelnde zur Rechenschaft gezogen werden und Medien selbstverständlich eine Rolle zukommt, mit einer „Attacke“.[9]
Das größere Bild
Tatsächlich hatte es im Vorfeld der Verabschiedung der Resolution eine ganze Reihe offener Briefe von zivilgesellschaftlichen Organisationen aus dem Süden und Norden gegeben.[10] Auch intensive Social-Media-Kampagnen wurden während der WHA lanciert, besonders via Twitter. Es wäre der bessere Schluss gewesen, hätte Deutschland diese laute öffentliche Kritik als Ausdruck der Dringlichkeit und Reichweite des Themas interpretiert. Etliche Länder haben das getan und trotz anfänglich kritischer Haltung aus freien Stücken für die Resolution gestimmt. Manche betonten dabei ausdrücklich, trotz des vielleicht nicht optimalen Prozesses die inhaltlichen Aussagen der Resolution für sehr wichtig zu halten.
Zivilgesellschaft als böser Bube
Wirft man einen Blick auf aktuelle WHO-Prozesse, so erscheint die rhetorische Schärfe der deutschen Reaktion zudem in einem besonders problematischen Licht. Im Zuge ihrer Umstrukturierung möchte die WHO u.a. die Zusammenarbeit mit zivilgesellschaftlichen Akteuren neu regulieren. Einige Vorschläge dazu sind höchst kritikwürdig, wie mehrere NGOs (darunter auch die Pharma-Kampagne) in einem aktuellen Papier mahnen.[11] Auf der Exekutivratsitzung nach der WHA wurden jene Vorschläge auch diskutiert. Beschwert sich nun Deutschland, wie das in eben jener Sitzung geschah, nachdrücklich über Medien und NGOs, ist dem Diskurs sicher nicht geholfen.[12] Zumal nicht in einer Zeit, in der „schrumpfende Räume“ Zivilgesellschaft und Journalisten weltweit zunehmend zu schaffen machen.
Dünnes Alibi
Abseits der aufgeheizten Atmosphäre lassen sich mit kühlem Blick vor allem zwei Dinge aus den Genfer Chaostagen ablesen. Zum einen, dass die Bundesregierung von der Welt beim Wort genommen wird, wenn sie sich als treibende Kraft für eine bessere globale Gesundheit darstellt. Zumal, wenn dies so öffentlichkeitswirksam geschieht, wie zuletzt etwa bei der Gründung des Global Health Hub Germany (wir berichteten[13]).
Die Bundesregierung sollte diesen von ihr selbst geschürten Erwartungen konstruktiv begegnen und Farbe bekennen. Ihr Rückzug auf Prozessmodalitäten als Hauptgrund für die WHA-Blockade ist stattdessen ein äußerst dünnes Alibi.[14] Ein Blick auf die von Deutschland eingebrachten Änderungswünsche, die die Resolution weitgehend zahnlos gemacht hätten, zeigt dies in aller Klarheit.
Ins Abseits manövriert
Zum anderen ist festzustellen, dass das Thema Transparenz im medizinischen Bereich mit aller Macht in die globale Öffentlichkeit drängt. Die von der Resolution angesprochenen Probleme sind zwar nicht neu, doch erst unter dem Eindruck steigender finanzieller Belastung der Versorgungssysteme und PatientInnen in Industrieländern lässt sich die globale Debatte nicht mehr ausbremsen.
Die Weltgesundheitsorganisation hat mit der Transparenz-Resolution in weiten Bereichen ein klares Mandat erhalten, für mehr Durchblick bei Arzneimittelpreisen, Forschungskosten und Studienergebnissen zu sorgen. Aber auch die Mitgliedsstaaten der WHO müssen ihre Hausaufgaben machen. Die Bundesregierung täte gut daran, sich den Herausforderungen zu stellen, statt vor strukturellen Problemen die Augen zu verschließen. Nicht nur ihre Glaubwürdigkeit als „Global Health Champion“ steht dabei auf dem Spiel, sondern vor allem die Möglichkeit einer besseren Gesundheit für Menschen weltweit. (MK)
Artikel aus dem Pharma-Brief 3/2019, S.1
Foto © WHO/A.Tardy
[1] Health Policy Watch (2019) World Health Assembly Approves Milestone Resolution On Price Transparency. www.healthpolicy-watch.org/world-health-assembly-approves-milestone-resolution-on-price-transparency/ [Zugriff 6.6.2019]
[2] WHO (2019) Improving the transparency of markets for medicines, vaccines, and other health products. http://apps.who.int/gb/ebwha/pdf_files/WHA72/A72_ACONF2Rev1-en.pdf [Zugriff 7.6.2019]
[3] Lancet (2019) UK, Germany, dissociate from WHO drug pricing resolution. 393, p 2287 https://linkinghub.elsevier.com/retrieve/pii/S0140-6736(19)31329-7
[4] WHO (2019) Improving the transparency of markets for medicines, vaccines, and other health products. Entwurf vom 23.5.2019 www.keionline.org/30823 [Zugriff 24.6.2019]
[5] Der bei der WHO verwendete Begriff in diesem Zusammenhang ist „dissociate“.
[6] Ärzteblatt (2019) Streit um WHO-Resolution für mehr Transparenz bei Arzneimittelkosten. www.aerzteblatt.de/nachrichten/103372/Streit-um-WHO-Resolution-fuer-mehr-Transparenz-bei-Arzneimittelkosten [Zugriff 6.6.2019]
[7] Devex (2019) Transparency, migrant health wrap up 72nd World Health Assembly. www.devex.com/news/transparency-migrant-health-wrap-up-72nd-world-health-assembly-95001 [Zugriff 7.6.2019]
[8] Reuters (2019) WHO agrees on watered down resolution on transparency in drug costs. www.reuters.com/article/us-health-pricing/who-agrees-watered-down-resolution-on-transparency-in-drug-costs-idUSKCN1SY0W4 [Zugriff 7.6.2019]
[9] Persönliche Mitteilung vom 29.5.2019. Weitere Informationen zur Arbeit von Medicines Law & Policy: https://medicineslawandpolicy.org/
[10] Siehe http://bit.ly/OpenLetterToGermany [Zugriff 7.6.2019] und www.bukopharma.de/images/aktuelles/Offener_Brief_WHA_72_Transparenz_Resolution.pdf
[11] Geneva Global Health Hub (2019) Towards a more meaningful engagement of WHO with civil society. http://g2h2.org/posts/civilsocietyengagement/ [Zugriff 07.06.2019]
[12] Health Policy Watch (2019) WHO’s EB Considers New Ways To Work With NGOs – Some Countries Criticise Activists’ Role At WHA 72. https://www.healthpolicy-watch.org/whos-eb-considers-new-ways-to-work-with-ngos-some-countries-criticise-activists-role-at-wha72/ [Zugriff 14.06.2019]
[13] Pharma Brief (2019) Interessengruppen auf den Leim gegangen? Nr. 8-9, S. 1
[14] Deutscher Bundestag (2019) Plenarprotokoll 19/103. Anlage 2. Schriftliche Antworten auf Fragen der Fragestunde (Drucksache 19/10536). Frage 48. S. 12591. http://dipbt.bundestag.de/dip21/btp/19/19103.pdf [Zugriff 14.06.2019]
Wir kennen die Realität nicht
Wenig Daten zu Antibiotika-Resistenzen weltweit
Im Oktober 2015 führte die WHO ein standardisiertes System zur internationalen Überwachung antimikrobieller Resistenzen ein. Das Global Antimicrobial Resistance Surveillance System (GLASS) soll verlässliche Daten zur weltweiten Resistenzproblematik liefern und damit nationale, regionale und globale Aktionspläne unterstützen. Aber wie gut funktioniert die Datenerhebung und wie verlässlich sind die gewonnenen Informationen? Welche Probleme gibt es bei der Implementierung von GLASS in einem armen Land wie Nigeria. Und wo gibt es noch Baustellen in Deutschland? Dr. Gerhard Schwarzkopf Steinhauser – Experte im Bereich Mikrobiologie und Infektionsschutz stand uns dazu Rede und Antwort.
Seit 2016 können Daten zu antimikrobiellen Resistenzen in die GLASS Datenbank eingespeist werden. 72 Länder nehmen inzwischen an dem Programm teil. Wissen wir nun mehr über die globale Resistenzlage?
Etliche Länder haben GLASS zwar ratifiziert und sich damit verpflichtet, nach einem vorgegebenen Schema Daten zu liefern. Die Datengrundlage ist aber ziemlich lückenhaft, entspricht nicht den Qualitätsanforderungen und ist in keinster Weise repräsentativ.
Wo hakt es bei der Datenerhebung?
Entscheidend ist, dass die Resistenztestung nach bestimmten Qualitätsstandards erfolgt – GLASS empfiehlt dazu die europäische Methode EUCAST oder das amerikanische CLSI System. Die Resistenztestung muss somit auf streng definierten Medien und mit ganz bestimmten labortechnischen Methoden erfolgen. Wissen und Technik sind aber in vielen Krankenhäusern nicht vorhanden – das gilt ganz besonders für arme Länder. Nigeria z.B. hat GLASS ratifiziert und ist dabei, in Kooperation mit dem RKI die Datenerhebungen zu beginnen. Dafür müssen aber zunächst die Voraussetzungen geschaffen werden. Selbst wenn die nötige Technik verfügbar ist, gibt es derzeit noch erhebliche Lücken beim Wissensstand des Personals in den mikrobiologischen Labors.
Sie halten die erhobenen Daten außerdem für wenig repräsentativ …
In Nigeria müssen Patienten die Diagnostik selbst bezahlen, deshalb wird nicht in ausreichender Menge diagnostiziert. Wenn z.B. bei jedem komplizierten Harnwegsinfekt eine mikrobiologische Testung gemacht werden würde, dann wäre die Datenlage repräsentativ. Wenn die Testung vom Geldbeutel der Patienten abhängt, gilt das nicht.
Ein Problem ist auch in vielen Ländern die Trennung des Gesundheitssystems in einen öffentlichen und einen privaten Sektor. Die GLASS Datenbank unterscheidet nicht zwischen den Daten aus öffentlichen und privaten Gesundheitseinrichtungen. Sie gibt auch nicht vor, welche oder wie viele Einrichtungen Daten liefern sollen. Festgeschrieben ist nur, dass die Auswahl repräsentativ sein soll. Das ist ein Manko. Wenn man Daten erhebt, muss man wissen, wo die herkommen – schließlich ist bei armen Bevölkerungsteilen eine andere Epidemiologie zu erwarten als bei reichen Bevölkerungsgruppen. Schon aufgrund der Lebensweise, des Zugangs zu Trinkwasser und der Ernährungsgewohnheiten sind möglicherweise die Erreger bei bakteriellen Infektionen höchst unterschiedlich.
Und wie steht es nun in Deutschland und Europa?
Es gibt Länder, wo die Datenerfassung streng geregelt ist – etwa in den Niederlanden oder in den skandinavischen Ländern inklusive Dänemark. In Deutschland gibt es dagegen gewaltige Schwächen. Zwar ist die Erhebung von Daten zum Antibiotika-Verbrauch und zur Resistenzlage im Infektionsschutzgesetz gesetzlich vorgeschrieben. Aber die Übermittlung dieser Daten an die nationale Datenbank zur Antibiotika-Resistenz-Surveillance (ARS) des RKI ist freiwillig. Die ARS-Daten sind daher derzeit nicht repräsentativ. Eine Verpflichtung zur Datenübermittlung ist wiederum Ländersache. Bayern will beispielsweise eine eigene Datenbank einrichten, was nicht zielführend ist.
Was wäre die Lösung für all diese Probleme?
Zweierlei: Eine vernünftige Diagnostik und eine Verpflichtung zur Übermittlung sämtlicher Daten. Für arme Länder heißt das auch, einen nationalen Gesundheitsservice zu etablieren, der eine gute Versorgung für alle garantiert. Denn nur ein guter Zugang zu Gesundheitsdienstleistungen und zu Diagnostika ermöglicht eine gute Kenntnis des Gesundheitszustands und der Resistenzlage innerhalb der Bevölkerung. Bisher wissen wir nicht, wie gravierend die Resistenzraten tatsächlich sind. Dazu müssten wir die Realität besser kennen.
Artikel aus dem Pharma-Brief 4-5/2019, S.14
Bild Dr. Schwarzkopf Steinhauser © Jörg Schaaber
[1] Global Health Protection Programme des Bundesministeriums für Gesundheit: NiCaDe https://ghpp.de/de/projekte/nicade [Zugriff 24.7.2019]
[2] Nigeria Centre for Disease Control (2019) NCDC and RKI Launch New Project to Strengthen Health Security in Nigeria, 13 June https://ncdc.gov.ng/news/181/ncdc-and-rki-launch-new-project-to-strengthen-health-security-in-nigeria [Zugriff 23.7.19]
Wo bleibt der Nutzen?
IQWiG zieht Bilanz nach 7 Jahren Bewertung
Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) kommt zu einem ernüchternden Urteil: Nur wenige neue Arzneimittel bringen PatientInnen substanzielle Vorteile. Das Institut bleibt aber nicht bei einer Analyse stehen, es fordert eine Umorientierung der Medikamentenforschung.[1]
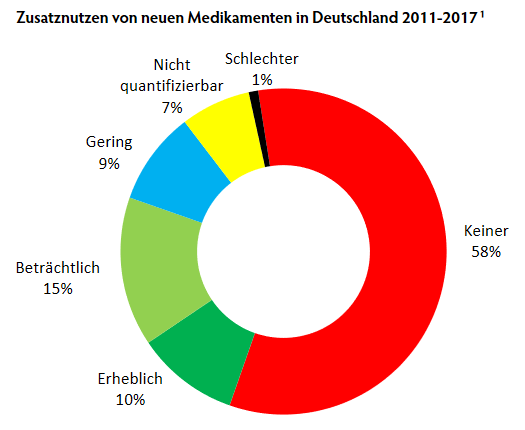
Seit 2011 müssen alle neuen Medikamente, die in Deutschland auf den Markt kommen, auf ihren Zusatznutzen bewertet werden. Für die wissenschaftliche Bewertung ist mit wenigen Ausnahmen[2] das IQWiG zuständig, die endgültigen Entscheidungen trifft der Gemeinsame Bundesausschuss (G-BA).[3] Von 2011 bis 2017 wurden 216 Medikamente durch das Institut bewertet, davon waren 152 neue Wirkstoffe und 64 neue Indikationen. Für 125 der Medikamente (58%) wurden keine Daten vorgelegt, die eine Verringerung der Sterblichkeit, der Symptome oder Verbesserung der Lebensqualität bestätigt hätten. Zwei Mittel (1%) waren sogar schlechter als die etablierte Vergleichstherapie.
Nur einem Viertel der Neueinführungen (54 Mittel) konnte ein beträchtlicher oder erheblicher Zusatznutzen bescheinigt werden. 16% (35) hatten einen geringen oder nicht quantifizierbaren Zusatznutzen. Ein genauerer Blick relativiert selbst diese Zahlen. Denn bei knapp der Hälfte (42%) dieser Mittel konnte eine Verbesserung nur für bestimmte PatientInnengruppen festgestellt werden.
Am schlechtesten schneiden Psychopharmaka (nur 6% mit Zusatznutzen) und Mittel gegen Diabetes ab (17% mit Zusatznutzen). Auffällig ist das Ungleichgewicht bei den Anwendungsgebieten: über ein Drittel (82) sind Krebsmedikamente. Diese schneiden bei der Bewertung deutlich besser ab, 59% konnte ein Zusatznutzen bescheinigt werden. Ähnliches gilt für die zweitgrößte therapeutische Gruppe, den 29 Mitteln gegen Infektionen (vor allem Hepatitis C und HIV), 62% mit Zusatznutzen.
Ungewissheit
Was verbirgt sich hinter der großen Gruppe von Medikamenten, denen kein Zusatznutzen bescheinigt werden konnte? In vielen Fällen sorgen ungeeignete Studien für ein negatives Urteil. Wenn nur gegen Placebo getestet wurde (64 Mittel), statt gegen eine Vergleichstherapie, kann man gar nicht beurteilen, ob das Medikament schlechter, besser oder gleichgut wirkt. Ebenfalls häufig (42 Mittel) war in den Studien ein ungeeignetes Vergleichsmedikament gewählt worden (für die Indikation gar nicht zugelassen, ungeeignete Dosis gewählt u.a.). 19 Medikamente waren nicht besser als die etablierte Therapie.
Auch die Hoffnung, dass nach Zulassung weiter geforscht wird und sich die die Ungewissheit dadurch auflöst, erfüllt sich selten. Entweder werden geeignete Studien gar nicht erst durchgeführt oder die Endergebnisse[4] bzw. besser gemachte Studien zeigen dann keinen zusätzlichen Nutzen.
Auf jeden Fall macht die Ungewissheit über den Nutzen bei Zulassung vernünftige Therapieentscheidungen schwierig.
Mehr vom Gleichen
Auffällig ist die große Ähnlichkeit etlicher erfolgreicher neuer Medikamente, die auf dem gleichen Wirkprinzip basieren. So sind ein Viertel aller positiv bewerteten Krebsmedikamente PD-1 oder PD-L1 Inhibitoren, weitere befinden sich in der Forschungspipeline. Alle neuen Hepatitis C-Medikamente basieren auf direkter antiviraler Wirkung. Das stellt eine Verschwendung von Forschungsgeldern dar (die die Allgemeinheit über hohe Medikamentenpreise refinanziert).
Neue Lösungen gefragt
Die drei MitarbeiterInnen des IQWiG formulieren klare Änderungsvorschläge. Als erster Schritt wird ein Umdenken bei der Zulassung gefordert. Es sollten wieder ausreichend große Phase III-Studien durchgeführt werden, die Ergebnisse messen, die für PatientInnen relevant sind (und nicht nur die Verbesserung von Laborwerten). Um Daten für eine Nutzenbewertung zu gewinnen, sollte – wo möglich – gegen die etablierte Therapie verglichen werden. Bei Entscheidungen über die Erstattung und Preise dürften marginale Fortschritte und unsichere Ergebnisse nicht belohnt werden.
Langfristig müsse die Gesundheitspolitik eine aktivere Rolle übernehmen: Statt passiv darauf zu warten, was die Pharmaindustrie entwickelt, sollte die Gesellschaft selbst Prioritäten für die Forschung setzen. Ein Vergleich mit der Entwicklungspipeline der Industrie mit dem tatsächlichen Bedarf kann Lücken identifizieren. Öffentlich finanzierte Forschungsprogramme können eine wirksame Maßnahme sein. Das beweist für die vernachlässigten Krankheiten bereits seit einiger Zeit die Drugs for Neglected Diseases initiative (DNDi), die erfolgreich Medikamente für Tropenkrankheiten entwickelt. Im Bereich der Antibiotikaforschung sind die WHO und auch die Bundesregierung aktiv geworden. Auch andere Modelle wie Forschung als öffentliches Unternehmen oder Open Source böten vielversprechende Möglichkeiten. (JS)
Artikel aus dem Pharma-Brief 4-5/2019, S.13
[1] Wieseler B et al. (2019) New drugs: where did we go wrong and what can we do better? BMJ; 366, p i4340
[2] Medikamente gegen seltene Krankheiten (Orphan Drugs) werden bis zu einem Jahresumsatz von 50 Mio. € durch den G-BA selbst bewertet. Dabei gilt aufgrund der gesetzlichen Vorgaben (AMNOG) ein fiktiver Zusatznutzen als belegt. Der G-BA kann nur noch das Ausmaß festlegen bzw. entscheiden, dass er einen Zusatznutzen nur aus rein rechtlichen Verpflichtungen erteilt.
[3] Pharma-Brief (2013) Ein Erfolgsmodell soll abgeschafft werden. Nr. 8-9, S. 6
[4] Pharma-Brief (2019) Die nächste Schlappe. Nr. 2, S. 6
Pharma-Brief Spezial
Hier finden Sie eine separate Auflistung des Pharma-Brief Spezial. Dies sind Sonderausgaben, die sich auf unterschiedliche Themenschwerpunkte konzentrieren.
Pharma-Brief Archiv
Pharma-Brief Archiv
Unsere Fachzeitschrift Pharma-Brief erscheint acht Mal pro Jahr und bietet gut recherchierte Beiträge rund um das Thema globale Gesundheit. Sie informiert über Zugangsprobleme bei Medikamenten, Arzneimittelrisiken und Nutzenbewertung, mangelnde Transparenz des Arzneimittelmarktes, vernachlässigte Krankheiten, illegale Pharmageschäfte, internationale Gesundheitspolitik und auch über Projekte der BUKO Pharma-Kampagne. Zweimal jährlich erscheint außerdem eine Doppelausgabe mit dem Pharma-Brief Spezial als Beilage. Die Broschüren beleuchten jeweils ein Schwerpunktthema.
Abonnieren Sie den Pharma-Brief und bleiben Sie auf dem Laufenden!
Sie können hier alle Jahrgänge des Pharma-Briefes ab 1981 online lesen.