Wie man es besser machen kann
Die Universität Nottingham sorgt für Transparenz bei Studien
Die Universität Nottingham ist ein europäischer Vorreiter in Sachen Transparenz bei klinischen Studien. Von über 95% der fälligen Studien wurde mittlerweile eine Zusammenfassung der Ergebnisse im europäischen Studienregister EudraCT eingetragen – ein steiler Anstieg verglichen mit 2018, damals waren nur 8% veröffentlicht. Till Bruckner von TranspariMED fragte die Universität, wie sie mit ihren ungemeldeten Studien umgegangen ist und was andere europäische Universitäten davon lernen können.
Wann habt ihr angefangen, systematisch die fehlenden Studienergebnisse in EudraCT hochzuladen?
Die Universität Nottingham hat ihre Studienregistrierungen in EudraCT im Dezember 2018 geprüft und unmittelbar angefangen fehlende Ergebnisse hochzuladen oder zu aktualisieren. Dieser Prozess war im März 2019 abgeschlossen.
Zur gleichen Zeit hat die Universität ihre Richtlinien, Systeme und Prozesse überprüft und überarbeitet, um sicherzugehen, dass die zusammengefassten Ergebnisse von den verantwortlichen WissenschaftlerInnen künftig rechtzeitig den entsprechenden Registern gemeldet werden. Ein neuer Leitfaden zur Studienregistrierung wurde am 17. Dezember 2018 veröffentlicht.
Dieser Leitfaden wurde regelmäßig dem wissenschaftlichem, forschendem Personal kommuniziert. Gleichzeitig gab es Unterstützung von unserem Research Governance Team, um bei der angemessenen Studienregistrierung und Ergebnismeldung zu helfen.
Wie viele Ergebnisse haben gefehlt, als ihr angefangen habt und wie viele habt ihr seitdem hochgeladen?
46 Studienergebnisse wurden während der Überprüfung als potenziell fehlend ermittelt. Bei einer stellte sich heraus, dass es sich um keine klinische Studie handelte, eine weitere Studie wurde zwar registriert, aber gar nicht durchgeführt. Diese Angaben wurden korrigiert und alle anderen Studienergebnisse wurden hochgeladen.
Wie ist der Prozess organisiert? Wer macht was?
Die Leiterin der Research Governance hat detailliert jeden Registereintrag geprüft und eine ausführliche Analyse zu den nicht gemeldeten Ergebnissen durchgeführt und den verantwortlichen Studienleiter identifiziert. Alle wurden von der Leiterin der Research Governance und dem Vize-Kanzler der Fakultät mit der Bitte kontaktiert, die Ergebnisse zu veröffentlichen. Gleichzeitig wurde Unterstützung und Beratung angeboten.
Um den Rückstand schnellstmöglich aufzuholen hat die Leiterin der Research Governance in einer beachtlichen Zahl von Fällen die Ergebnisse von Studienleiter direkt erhalten. Anschließend hat sie bei der europäischen Zulassungsbehörde EMA um den Transfer der Studieneinträge zu ihrem Benutzerkonto gebeten. Anschließend hat sie das Register aktualisiert und dann die britische Zulassungsbehörde MHRA[1] kontaktiert, damit dieses den Status der Studien in EudraCT zu „abgeschlossen“ ändert.
Wie seid ihr mit alten Studien umgegangen, die fälschlicherweise als „laufend“ im EudraCT gelistet waren?
Wenn Studien fehlerhaft registriert oder fälschlich als „laufend“ gelistet waren, hat die Leiterin der Research Governance sich in Verbindung mit der EMA und dem MRHA gesetzt, um den Eintrag zu korrigieren.
Welche Ressourcen wurden benötigt? Musste zusätzliches Personal angestellt werden? Wie lange dauerte es pro Studie?
Bis heute wurde die Überprüfung und die nachfolgenden Prozesse überwiegend durch die Leiterin der Research Governance überwacht und durchgeführt.Zurzeit bekommt das Research Governance Team zwei zusätzliche Stellen, um die Qualität im Datenmanagement sowie bei der Überprüfung der Studien im Forschungsportfolio der Universität weiter zu fördern. Außerdem sollen sie die Forschenden unterstützen, ihrer Verantwortung bei der Studienregistrierung und Ergebnismeldung nachzukommen.
Die benötigte Zeit um jeden EudraCT Eintrag zu aktualisieren hing sehr von der Verfügbarkeit und dem Format der Daten ab, sowie von den Herausforderungen beim Hochladen im Register und der nachfolgenden Zusammenarbeit mit der EMA und dem MHRA. Im Durchschnitt brauchte es für jeden Eintrag mehrere Stunden.
Was waren die Haupthindernisse, auf die ihr gestoßen seid und wie habt ihr sie bewältigt?
Häufig mussten die wissenschaftlichen Daten und Tabellen neu formatiert werden, um mit EudraCT übereinzustimmen. Die WissenschaftlerInnen oder die Leiterin der Research Governance mussten die Daten per Hand in das geeignete Format umwandeln, das war sehr zeitraubend.
Da viele WissenschaftlerInnen und Studierende an den klinischen Studien beteiligt waren und persönlich für die Studienregistrierung und Ergebnisübermittlung verantwortlich waren, war die Überwachung und Aktualisierung der zentralen Einträge durch Research Governance Team nicht einfach. Um diese Schwierigkeit zu umgehen, hat die Leiterin ein Standardvorgehen eingeführt. Sie erhält von den Forschenden die EudraCT Nummer und die Registrierung für CTIMPs,[2] damit alle künftigen Studien unter ihrem Account registriert werden. Dadurch wird verhindert, dass ungewollt bei einem Account Details verloren gehen. Gleichzeitig wird die zentrale Überwachung unterstützt und es wird sichergestellt, dass die WissenschaftlerInnen, die die klinischen Studien durchführen, daran erinnert werden, Ergebnisse zu melden und zu aktualisieren.
Das Research Governance Team pflegt eine Datenbank mit allen Studien, die gemäß den gesetzlichen Vorgaben und Vorschriften des Gesundheitsministeriums als klinische Studien gemeldet werden müssen. Allerdings führt die Universität auch viele andere Forschungsvorhaben durch, für die diese Kriterien nicht gelten. Das Governance Team hat keinen Überblick über solche Studien. Momentan überprüfen wir, wie wir auch diese Studien zukünftig verfolgen können.
Was sind die drei wichtigsten Dinge, die andere Verantwortliche tun können, um die Studienmeldung für Universitäten zu vereinfachen?
EudraCT, wie auch die meisten anderen Register, bietet keine Möglichkeit, den größeren Kontext darzustellen, in dem eine Studie stattfindet, Ergebnisse zu diskutieren sowie nächste Schritte zu besprechen. Die Einführung eines gemeinsamen Formats innerhalb oder besser noch registerübergreifend würde die oben genannten Formatierungsprobleme lösen. Weitere Funktionen, um Inhalte sowie nächste Schritte festzuhalten, könnten den Nutzen für und die Forschungsgemeinschaft erhöhen und die Compliance verbessern.
Es gibt keine eindeutige Definition, was genau zu klinischer Forschung zählt – trotz des Versuchs der WHO eine Definition zu finden.[3] Um den Anforderungen des International Committee of Medical Journal Editors zu genügen,[4] werden Register auch für nicht-klinische (aber medizinische) und physiologische Studien benutzt.
Das ist die Voraussetzung dafür, dass die Ergebnisse in den Fachzeitschriften auch veröffentlicht werden können, unabhängig davon, ob die Studie tatsächlich als klinische Forschung definiert wurde oder nicht. Es gibt Unklarheiten, was tatsächlich in einem öffentlichen Register eingetragen werden muss und was nicht.
Viele dieser Studien sind Studierendenprojekte, die oftmals keine neuartige Forschung beinhalten und wenig zu der medizinischen Wissensbasis beitragen. Deshalb würden die Register gut daran tun, einen Mechanismus zu haben, mit dem die Forschenden und Sponsoren angeben können, um welchen Studientyp es sich handelt und ob beabsichtigt ist, die Ergebnisse zu veröffentlichen oder die Wissensbasis zur klinischen Anwendung zu erweitern.
Bisher haben Register außerdem keinen Mechanismus, der Einträge löscht oder den Studienstatus verändert, wenn eine Studie nie begonnen oder so frühzeitig gestoppt wurde, dass es keine Ergebnisse zu melden gibt.
Basierend auf eurer Erfahrung, was würdet ihr anders machen, wenn ihr den gesamten Prozess heute noch einmal starten würdet?
Wir würden die Maßnahmen ergreifen, die wir erst im Laufe des Prozesses erarbeitet haben, insbesondere die erweiterte zentrale Prüfung, Analyse- und Überwachungsprozeduren.
Außerdem würden wir die Forschungsgemeinschaft besser in die Bedeutung der Pflege der Registereinträge einbeziehen. Die Leiterin der Research Governance wird nun regelmäßige Überprüfungen durchführen, auf Fakultätrats- und Komiteeebene aktuelle Informationen liefern, wie Forschende positive Fortschritte machen. Darüber hinaus wird darauf hingewiesen, wo Verbesserungen notwendig sind, um Compliance zu gewährleisten.
Was ist euer Rat für andere nicht-kommerzielle Studiensponsoren, die das Meldeverhalten ihrer klinischen Studien verbessern möchten?
Seid vorbereitet und gewillt, intensive Aktivitäten durchzuführen, um die Einträge zu aktualisieren. Eventuell mithilfe eines engagierten Task Teams, das die Aufgaben sanft und verständnisvoll angeht. Später, das ist sehr entscheidend, sollten klare Rahmenbedingungen gesetzt werden, Erwartungen abgefragt und Anleitungen für die Pflege der Register erarbeitet werden. All dies sollte den Forschenden eindeutig kommuniziert werden, damit Verantwortlichkeiten klar sind und der erzielte Fortschritt stabil bleibt und zur Routine werden kann.
TranspariMED dankt der Universität Nottingham, dass sie ihre Erfahrungen mit der breiteren medizinischen Forschungsgemeinschaft teilt. Diese Fallstudie ist auch einzeln als PDF Download verfügbar in der Sammlung von Transparenzinstrumenten, die TranspariMED für Universitäten zusammengestellt hat: www.transparimed.org/resources
Der vorliegende Text wurde ursprünglich von Till Bruckner verfasst, von Hannah Eger übersetzt und von Jörg Schaaber überarbeitet. Er unterliegt wie das Original [5] einer Creative Commons BY 3.0 Lizenz.
Artikel aus dem Pharma-Brief 4-5/2019, S.10
Bild Universität Nottingham © dietrichherlan/istock
[1] Medicines and Healthcare products Regulatory Agency
[2] Clinical trials of investigative medicinal products
[3] www.who.int/topics/clinical_trials/en
[4] DeAngelis et al. (2004) Clinical trial registration: a statement from the International Committee of Medical Journal Editors. Lancet; 364, p 911
[5] www.bukopharma.de/images/pressemitteilungen/2019/Clinical_Trial_Transparency_EU_Universities_2019.pdf
Klinische Studien:
Universitäten lassen Transparenz vermissen
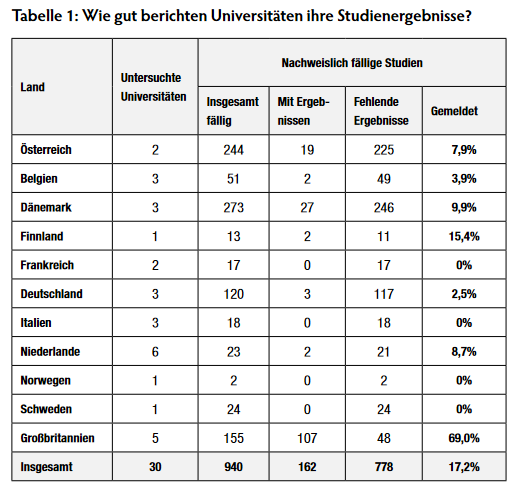
Zum Schutz von PatientInnen müssen die Ergebnisse aller klinischen Studien veröffentlicht werden. Doch eine Untersuchung von europäischen Universitäten zeigt, dass viele diese Verpflichtung schlecht erfüllen. Ein gemeinsamer Bericht von BUKO Pharma-Kampagne, TranspariMED (Vereinigtes Königreich), Test Aankoop (Belgien) und Health Action International (Amsterdam) macht gravierende Defizite deutlich. Untersucht wurden die 30 Universitäten, die die meisten Studien durchführen.[1]
Klinische Studienergebnisse nicht zu melden, hat erhebliche negative Konsequenzen für PatientInnen und die öffentliche Gesundheit. Seit Juli 2014 schreibt die Europäische Union (EU) vor, dass für jede klinische Studie, die im EU Clinical Trials Register eingetragen ist, eine Zusammenfassung ihrer Ergebnisse innerhalb von 12 Monaten nach Studienabschluss (sechs Monate für pädiatrische Studien) im europäischen Studienregister veröffentlichen muss. Diese Regulierung trifft auch auf Studien zu, die vor 2014 abgeschlossen wurden und gilt unabhängig davon, ob die Studienergebnisse bereits in der Fachliteratur publiziert wurden. Das bedeutet, dass klinischen Studien, bei denen die Sponsoren keine Zusammenfassung der Ergebnisse im EU-Register veröffentlichten, gegen die Transparenzverordnung der EU verstoßen.
Die Ergebnisse im Überblick
Von den 30 europäischen Universitäten, die die meisten Studien gemeldet haben, fehlen insgesamt nachweisbar Ergebnisse von 778 fälligen klinischen Studien im europäischen Studienregister, das entspricht 83% (Tabelle 1). Lässt man die Universitäten im Vereinigten Königreich außen vor, liegt die Melderate bei lediglich 7%. Die absolute Zahl an fehlenden Ergebnissen von fälligen Studien ist vermutlich deutlich höher.
Nur drei Universitäten schneiden gut ab: University of Oxford, University College London und King’s College London. Diese Einrichtungen haben bereits über 80% ihrer fälligen Studienergebnisse veröffentlicht. 14 der 30 untersuchten Universitäten haben dagegen nicht ein einziges Studienergebnis veröffentlicht. Das trifft auf alle Universitäten in Frankreich, Italien, Norwegen und Schweden zu. Auch die verbliebenen 13 Universitäten schneiden mit Melderaten von 2 – 33% schlecht ab.
Die Tatsache, dass britische Universitäten ihre europäischen Peers mit großem Abstand übertreffen, liegt am Druck des Parlaments, der Forschungsförderer und der Öffentlichkeit. Die starke Performance einiger Universitäten im Vereinigten Königreich zeigt, dass Universitäten in ganz Europa es deutlich besser machen können – und auch müssen.
Empfehlungen
Universitäten sollten die Ergebnisse von allen klinischen Studien – vergangene, gegenwärtige und zukünftige – in allen Registern veröffentlichen, in denen die Studien eingetragen wurden. Bei laufenden und künftigen Studien sollten Universitäten die Ergebnisse innerhalb von zwölf Monaten nach Abschluss veröffentlichen.
Darüber hinaus sollten die Universitäten die gemeinsame Erklärung der International Clinical Trials Registry Platform (ICTRP) der Weltgesundheitsorganisation (WHO)[2] unterzeichnen und die dort beschriebenen Regeln zu Transparenz befolgen.
Nationale Zulassungsbehörden sollten regelmäßig den Status aller Studien überprüfen, die in ihren Registern noch als „laufend“ gelistet sind, und ihren Status – falls erforderlich – in „abgeschlossen“ ändern.
Nationale Forschungsförderer sollten ebenfalls die gemeinsame Erklärung der WHO unterzeichnen, um PatientInnen zu schützen und zu verhindern, dass von SteuerzahlerInnen finanzierte medizinische Forschung wegen Nichtveröffentlichung der Ergebnisse der Studien verschwendet werden.
Nationale Regierungen sollten systematisch kontrollieren, ob klinische Studien, die in ihrem Zuständigkeitsbereich durchgeführt werden, ihre Studienergebnisse in öffentlichen Registern innerhalb von zwölf Monaten veröffentlichen, wie es die Best Practices der WHO vorsehen. Studiensponsoren, die ihre Ergebnisse nicht innerhalb der Frist veröffentlichen, sollten sanktioniert werden. Das Vereinigte Königreich bereitet entsprechende Schritte gegenwärtig vor.
Wie gut sind die Länder?
Dieser Bericht untersucht das Meldeverhalten von den 30 europäischen Universitäten mit den klinischen Studien, die der EU-Verordnung zu klinischen Studien unterliegen. Insgesamt haben diese Universitäten 4.575 klinische Studien gesponsert. Für 940 dieser Studien sind Ergebnisse nachweislich fällig. Allerdings haben lediglich 162 der nachweisbar fälligen Studien (17%) ihre Ergebnisse im EU Clinical Trials Register veröffentlicht. Bei den verbleibenden 778 Studien (83%) verstoßen die Universitäten somit gegen die Transparenzvorschriften der EU.
Die meisten der 778 Studien mit nachweislich fehlender Ergebnisberichterstattung wurden von Universitäten in Dänemark (246 Studien), Österreich (225) und Deutschland (117) durchgeführt. Von den untersuchten Universitäten in Frankreich, Italien, Norwegen und Schweden wurde kein einziges Studienergebnis im Register veröffentlicht. Manche Universitäten in Belgien, Deutschland und den Niederlanden haben ebenfalls für keine ihrer klinischen Studien Ergebnisse veröffentlicht. Nur ein paar britische Universitäten haben gut abgeschnitten, manche Institutionen rühmen sich mittlerweile mit Melderaten über 80%. Schließt man die britischen Universitäten von der Betrachtung aus, liegt die durchschnittliche Melderate in Europa gerade mal bei 7% und somit sogar niedriger als die 11%, die Forscher für europäische Universitäten im September 2018 ermittelt haben. Außerhalb des Vereinigten Königreichs fehlen Ergebnissen zu 730 von 785 nachweisbar fälligen Studien (93%).
In Deutschland
Von den einbezogenen drei deutschen Universitäten schneidet München mit 7% noch am besten ab, die Charité kommt auf 2% und Heidelberg hat kein einziges Ergebnis veröffentlicht. Positiv sticht in Deutschland nur die Uni Münster ab, die nicht unter den Top 30 Forschungsstätten ist (und deshalb in die vorliegende Untersuchung nicht mit einbezogen wurde). Sie hat 58,8% aller Studien veröffentlicht.[3]
Die obenstehenden Zahlen unterschätzen vermutlich signifikant den wahren Anteil an klinischen Studien, die wegen fehlender Veröffentlichung der Ergebnisse gegen die EU Regeln verstoßen. Das liegt daran, dass zahlreiche Studien als „laufend“ im europäischen Studienregister gelistet werden, obwohl sie schon längst abgeschlossen sind. Zum Beispiel haben Universitäten in den Niederlanden insgesamt 967 Studien durchgeführt, aber nur 23 davon (2,4%) sind als „abgeschlossen“ gekennzeichnet. Dieser geringe Anteil ist nicht plausibel, da die Registereinträge zeigen, dass viele dieser Studien vor über fünf Jahren begonnen wurden. Im Vereinigten Königreich, wo das nationale Register gerade aktualisiert wird, liegt der Anteil der „abgeschlossenen“ Studien bei 27,4%.
Im aktuellen Meldesystem laden die Universitäten direkt ihre zusammengefassten Ergebnisse in das EU Register hoch – als Studiensponsoren sind sie rechtlich dazu verpflichtet und der Prozess liegt komplett in ihrer eigenen Kontrolle. Allerdings können Universitäten nicht direkt den Status ihrer Studien (laufend, abgeschlossen) aktualisieren. Stattdessen müssen sie ihre nationale Zulassungsbehörde darüber informieren, dass eine Studie abgeschlossen ist. Die Behörde aktualisiert dann den Status der Studie im Register. In Ländern mit unerklärlich niedrigen Anteilen an „abgeschlossenen“ Studien, wie die Niederlande, ist es sehr wahrscheinlich, dass die nationalen Behörden eine große Zahl von Registereinträgen nicht geändert haben, obwohl die Studien abgeschlossen waren. Diese Behörden sollten dem positiven Beispiel der britischen MHRA folgen, und systematisch den Status aller klinischen Studien, die in ihrem Land durchgeführt wurden, durchsehen und aktualisieren.
Warum sind britische Universitäten besser?
Im Durchschnitt schneiden die britischen Universitäten deutlich besser ab als die in anderen Ländern. Die schwächste der fünf untersuchten Universitäten im Vereinigten Königreich hat eine Melderate von nur 25%, die zwei Stärksten – University of Oxford und King’s College London – haben bisher schon über 90% der fälligen Studienergebnisse veröffentlicht. Zum Vergleich: von einer Ausnahme abgesehen, hat nicht eine einzige Universität des europäischen Festlands eine höhere Melderate als 20%.
Britische Universitäten haben in Sachen Transparenz eine Führungsposition in Europa eingenommen. Ursache dafür war der Druck des Parlaments, der Forschungsförderer und der Öffentlichkeit.
Druck vom Parlament
Das Science and Technology Committee des britischen Parlaments hat 2018 -2019 eine Untersuchung zu wissenschaftlicher Integrität durchgeführt. Mitglieder des Ausschusses waren schockiert, als sie herausfanden, dass zahlreiche Universitäten regelmäßig gegen die Transparenzregeln verstoßen. Anfang 2019 warnte der Vorsitzende des Ausschusses die britischen Universitäten mit einem Schreiben, dass sie vor den Ausschuss zitiert würden und sich rechtfertigen müssten, wenn sie die fehlenden Studienergebnisse nicht bis Sommer 2019 in das Register einstellten.[4]
Druck von den Forschungsförderern
Die zwei öffentlichen medizinischen Forschungsförderungsorgane im Vereinigten Königreich, das NIHR und der MRC, sowie der private Wellcome Trust haben 2017 die gemeinsame Erklärung der WHO zur Veröffentlichung von Studienergebnissen2 unterzeichnet. Mit ihrer Unterschrift verpflichten sich die Forschungsförderer, die Regeln zur Studienregistrierung und Ergebnismeldung gemäß der WHO Best Practices zu befolgen und zu kontrollieren, ob die geförderten Projekte diese Regeln befolgen. Der MRC hat bereits ein exzellentes Review zu den von ihm geförderten klinischen Studien durchgeführt.[5] In den folgenden Jahren könnten britische Universitäten, die es versäumen ihre Studienergebnisse rechtzeitig in den Registern zu veröffentlichen, von weiteren Förderungen ausgeschlossen werden.
Öffentlicher Druck
Eine von TranspariMED initiierter loser Zusammenschluss von Gruppen, die sich um Integrität in der Gesundheitsversorgung kümmern, darunter Universities Allied for Essential Medicines (UAEM-UK), HealthWatch UK, Transparency International Health und STOPAIDS, hat sich an das Parlament gewendet, die Medien informiert und Druck auf die Universitäten ausgeübt, um eine bessere Meldepraxis für Studienergebnisse zu erreichen.
TranspariMED und UAEM-UK haben zudem mehrere Berichte zur Leistung einzelner britischer Universitäten veröffentlicht.[6] Zeitgleich hat sich die hauptsächlich in Großbritannien aktive AllTrials Kampagne[7] des Problems angenommen, unter anderem mit regelmäßigen E-Mails an ihre über 90.000 Unterstützer. Das EBM Data Lab der University of Oxford hat den EU Trials Tracker konzipiert, von dem die Daten für den vorliegenden Bericht stammen. Das EBM Data Lab arbeitet mit der AllTrials Kampagne zusammen und hat dem Parlamentsausschuss mit den notwendigen Daten zur Veröffentlichungspraxis von klinischen Studien der Universitäten versorgt.
Der gebündelte Druck hatte einen enormen Einfluss auf das Meldeverhalten der britischen Universitäten. Das King’s College London beispielsweise hat innerhalb nur eines halben Jahres seine Melderaten von 18% auf 93% verbessert. Die University of Nottingham, die vom Parlamentsausschuss 2018 wegen ihrer schlechten Leistung angeprangert wurde, hat inzwischen die Ergebniszusammenfassungen zu über 95% der von der Uni durchgeführten Studien veröffentlicht.
Soweit TranspariMED das beurteilen kann, arbeitet momentan jede medizinische Universität im Vereinigten Königreich hart daran, fehlende Studienergebnisse im EU Register hochzuladen und oftmals sogar in anderen Registern, wie das ISRCTN und das US Register Clinicaltrials.gov. Dadurch wird deutlich, dass wo ein Wille ist, auch ein Weg ist – andere Universitäten in Europa können also ebenfalls die Probleme lösen, wenn sie wollen. (Siehe Artikel zur Nottingham University auf S. 10.)
Momentan arbeitet die britische Regierung daran, ein umfassendes nationales Monitoringsystem für klinische Studien einzuführen. Es soll jede einzelne klinische Studie, die auf britischem Boden durchgeführt wird, nachverfolgen, einschließlich kommerzieller und länderübergreifender Studien. Damit soll sichergestellt werden, dass alle Studien registriert und ihre Ergebnisse veröffentlicht werden.
Relevanz für die Praxis
Da Verschweigen von Studienergebnissen ist kein Kavaliersdelikt. Ein Bericht von 2017 von Transparency International und Cochrane zeigt, dass es fehlende Ergebnisberichte von Studien gravierende negative Konsequenzen haben können:[8] Patienten geraten durch falsche Behandlungsentscheidungen in Gefahr, öffentliche Einrichtungen können keine informierten Entscheidungen über den Nutzen von Arzneimitteln treffen, öffentliche Gelder werden verschwendet und der medizinische Fortschritt wird verlangsamt.
Rechtliche Rahmenbedingungen
Eine EU-Verordnung schreibt seit Juli 2014 vor, dass eine Zusammenfassung der Ergebnisse für jede einzelne Studie, die im EU Studienregister EudraCT eingetragen ist, innerhalb von zwölf Monaten (bei pädiatrischen Studien sechs Monate) nach Studienabschluss veröffentlicht werden muss. Das bedeutet, dass alle in diesem Bericht ermittelten klinischen Studien, bei denen eine Zusammenfassung der Ergebnisse fehlt, gegen die Transparenzverordnung der EU verstoßen. Sie wurde eingeführt, um die Interessen der PatientInnen und SteuerzahlerInnen zu schützen.
Verschwendete Forschung
Ungemeldete Studien hemmen den Fortschritt in der Wissenschaft, schaden der öffentlichen Gesundheit und sind daher eine Verschwendung von Forschungsgeldern. In der Vergangenheit haben das Verschweigen der Ergebnisse von klinischen Studien zum Tod unzähliger PatientInnen und Verluste im Wert von Milliarden Euros verursacht.[9] Aus diesem Grund hat die Erklärung von Helsinki das Melden von Ergebnissen jeder klinischen Studie zu einer universeller ethischen Pflicht für alle medizinischen ForscherInnen weltweit erklärt.[10]
Nicht alle Studien, die ihre Ergebnisse nicht im EU Studienregister eingetragen haben, sind komplett unveröffentlicht. Jedoch weist die bestverfügbare Evidenz darauf hin, dass etwa von der Hälfte aller Studien, deren Ergebnisse im EU Register fehlen, auch nicht in Fachzeitschriften veröffentlicht wurden. Dadurch geraten Hunderte von Studien an europäischen Universitäten in Gefahr, eine Verschwendung von Forschungsgeldern zu werden, werden ihre Ergebnisse nicht bald veröffentlicht.
Universitäten müssen dringend ihre klinischen Studien im EU-Register, dem US-Register clinicaltrials.gov und anderen WHO Primärstudienregistern durchsehen, ungemeldete Studien identifizieren und sicherstellen, dass fehlende Eintragungen nachgeholt und die Ergebnisse einer Studie so bald wie möglich nach deren Abschluss veröffentlicht werden.
Global Best Practices
Die WHO Standards schreiben vor, dass die Ergebnisse jeder Interventionsstudie in jedem öffentlichem Register, in dem sie eingetragen sind, zwölf Monate nach Abschluss der Studie veröffentlicht werden. Die WHO hebt hervor, dass die Veröffentlichung von Studienergebnissen in der Fachliteratur kein Ersatz zur Meldung der Ergebnisse in öffentlichen Registern darstellt.
Best Practices, die gemeinsam von Cochrane und Transparency International entwickelt wurden, sehen ebenfalls vor, dass „eine Zusammenfassung der Ergebnisse für alle klinischen Studien in den Registern, in denen sie ursprünglich registriert wurden, innerhalb von zwölf Monaten nach Studienabschluss hochgeladen werden muss.“8 Beide Organisationen machen darauf aufmerksam, dass das nachträgliche Hochladen der Ergebnisse von allen vergangenen Studien in den Registern „die Gesundheitsversorgung und die Entscheidungsfindung von Regierungseinrichtungen zur Ressourcenverteilung verbessern würde, und gleichzeitig würden Milliarden von Dollar für medizinische Forschung davor bewahrt, für immer verloren zu sein.“
Übereinstimmend damit fordert die AllTrials Kampagne, dass „eine Zusammenfassung der Ergebnisse […] dort wo die Studie registriert wurde innerhalb eines Jahres nach Studienabschluss hochgeladen werden sollte.“
Es gibt gute Gründe dafür, dass alle Studienergebnisse in den Registern veröffentlicht werden sollten. Das Hochladen der Ergebnisse in den Registern beschleunigt den medizinischen Fortschritt, denn durch die 12-Monatsfrist können Ergebnisse deutlich schneller geteilt werden. Der Veröffentlichungsprozess in der Fachliteratur ist viel langwieriger.
Das Risiko, dass die Ergebnisse einer Studie nie veröffentlicht werden und eine Verschwendung von Forschung darstellen, wird minimiert. Das kann sonst zum Beispiel passieren, wenn der Studienleiter während des langwierigen Prozesses einer wissenschaftlichen Veröffentlichung stirbt oder seine Stelle wechselt.
Forschung hat ergeben, dass Studienergebnisse, die in Register hochgeladen wurden, üblicherweise ein verständlicheres und genaueres Bild der Ergebnisse, die für PatientInnen relevant sind, geben als wissenschaftliche Publikationen. Studienergebnisse in den Registern sind einfacher aufzufinden und öffentlich zugänglich. Das Melden in Registern vereinfacht es, die Studienergebnisse mit den ursprünglich festgelegten Zielen zu vergleichen. Somit werden schädliche Verletzungen der Sorgfaltspflicht in der Forschung, wie das „stille“ Zurückhalten unvorteilhafter Ergebnisse, Hinzufügen oder Ändern der ursprünglich festgelegten Endpunkte,[11] selektives Berichten von für den Sponsor günstigen Ergebnissen und Praktiken wie HARKing[12] und p-hacking,[13] weniger wahrscheinlich.[14]
Falsche Vorwände
Das International Committee of Medical Journal Editors befürwortet das Hochladen von Studienergebnissen in Studienregistern und betont, dass das nicht als Vorveröffentlichung eines Artikels betrachtet wird. Das bedeutet, dass wissenschaftliche Zeitschriften Artikel akzeptieren, auch wenn die Ergebnisse zuvor im Studienregister veröffentlicht wurden.[15] Da das Melden der Ergebnisse in den Registern üblicherweise schneller ist als eine wissenschaftliche Publikation, ist es nun Best Practice für wissenschaftliche Kommunikation, die Studienergebnisse in Registern zu veröffentlichen, bevor sie in der Fachliteratur erscheinen.
Der vorliegende Text wurde ursprünglich von Till Bruckner verfasst, von Hannah Eger übersetzt und von Jörg Schaaber überarbeitet. c Er unterliegt wie das Original [16] einer Creative Commons BY 3.0 Lizenz.
Artikel aus dem Pharma-Brief 4-5/2019, S.5
Bild window cleaning © Vikramjit Kakati
[1] Die Untersuchung wurde von Till Bruckner (TranspariMED) durchgeführt. Der vorliegende Text ist eine überarbeitete und leicht gekürzte Fassung des englischen Originals.
[2] WHO (2017) International Clinical Trials Registry Platform (ICTRP) Joint statement on public disclosure of results from clinical trials www.who.int/ictrp/results/jointstatement/en
[3] http://eu.trialstracker.net/sponsor/university-of-munster
[4] Bruckner T (2019) UK government promises national strategy to boost clinical trial reporting. 25 Feb. www.transparimed.org/single-post/2019/02/25/UK-government-promises-national-strategy-to-boost-clinical-trial-reporting
[5] MRC (2017) MRC Review of Clinical Trials. https://mrc.ukri.org/research/policies-and-guidance-for-researchers/review-of-clinical-trials
[6] www.transparimed.org/resources
[8] TI (2017) Clinical trials transparency https://docs.wixstatic.com/ugd/01f35d_def0082121a648529220e1d56df4b50a.pdf
[9] Bruckner T and Ellis B (2017) Clinical Trial Transparency https://media.wix.com/ugd/01f35d_0f2955eb88e34c02b82d886c528efeb4.pdf
[10] WMA (2019) Declaration of Helsinki www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects
[11] Altman DG et al. (2017) Harms of outcome switching in reports of randomised trials: CONSORT perspective. BMJ;356, p j396
[12] HARKing = Hypothesizing after the results are known. Neue Hypothesen aufstellen, wenn man die Ergebnisse schon kennt
[13] p-hacking. So lange mit den Daten spielen, bis das statistische Signifkanzniveau (p-Wert) doch noch erreicht wird. Üblicherweise gilt ein p-Wert unter 0,05 als signifikant (das Ergebnis ist dann zu 95% nicht zufällig)
[14] Munafò MR et al. (2017) A manifesto for reproducible science. Nature Human Behaviour; 1, article number 0021 www.nature.com/articles/s41562-016-0021
[15] ICMJE (2019) Clinical Trials www.icmje.org/recommendations/browse/publishing-and-editorial-issues/clinical-trial-registration.html [Zugriff 24.7.2019]
[16] www.bukopharma.de/images/pressemitteilungen/2019/Clinical_Trial_Transparency_EU_Universities_2019.pdf
Gesundheitshub krankt
Uneinigkeit bei Struktur und Mitbestimmung
Der Global Health Hub Germany (GHHG) bleibt ein Problemprojekt des Bundeministeriums für Gesundheit (BMG). Denn das Hauruck-Verfahren bei seiner Gründung rächt sich nun bei der Diskussion um die interne Entscheidungskultur. Obwohl der Hub schon Aktivitäten entfaltet, gibt es keine Satzung, die die Rechte von Mitgliedern und Lenkungskreis regelt.
Nach anhaltender externer Kritik, zuletzt etwa in einem Beitrag in welt-sichten,[1] rumort es mittlerweile vernehmlich in den „Eingeweiden“ des Hubs. Ursächlich dafür sind vor allem auch die Versäumnisse beim Aufbau des Prestige-Objekts (wir berichteten[2]).
Entzündet haben sich die Diskussionen innerhalb des GHHG vor allem an der Frage, wie die noch ausstehende Satzung aussehen soll und dabei besonders, in welchem Verfahren sie bearbeitet und verabschiedet werden wird. In einem Brief an das BMG und die Gesellschaft für Internationale Zusammenarbeit (GIZ) benennt Eva-Maria Schreiber, Bundestagsabgeordnete der Linken und Mitglied im Hub, das Problem:[3] Demnach sei ursprünglich zugesagt worden, die Satzung in einem transparenten Konsultationsprozess gemeinsam mit allen Mitgliedern zu erarbeiten – nun solle jedoch wohl zeitnah der Lenkungskreis allein eine finale Version verabschieden. Die GIZ bestreitet das. Mitglieder könnten bald im Intranet des Hubs Rückmeldungen zu der von GIZ und Lenkungskreis entworfene Satzung geben.
Dennoch stellen sich (mindestens) zwei kritische Frage. Zum Einen, auf welcher Grundlage der Interims-Lenkungskreis bei diesem Prozess eigentlich handeln kann. Zum Anderen, welche Rolle denn die Mitglieder des Hubs letztlich spielen, sofern basisdemokratisches Handeln wirklich angestrebt wird.
Henne, Hub und Ei
 Durch das Drängen des BMG, den GHHG möglichst schnell öffentlichkeitswirksam auftreten zu lassen, mangelt es ihm intern grundlegend an Verfahrensregeln. Dem wohlgemerkt extern bestimmten Interims-Lenkungskreis wurde nun unter Einbezug der nicht im Hub vertretenen GIZ die Rolle zugeschoben, diesen Schwachpunkt zu beheben. Der erster Entwurf für eine Satzung kam offenbar von der GIZ, die als Auftragnehmer des BMGs die Hub-Geschäftsstelle führt, dieser wurde dann vom Interims-Lenkungskreis diskutiert. Laut früherer Aussage des GHHG wird der Interims-Lenkungskreis auch schlussendlich die Kommentierung und Verabschiedung des Satzungsentwurfs vornehmen.[4]
Durch das Drängen des BMG, den GHHG möglichst schnell öffentlichkeitswirksam auftreten zu lassen, mangelt es ihm intern grundlegend an Verfahrensregeln. Dem wohlgemerkt extern bestimmten Interims-Lenkungskreis wurde nun unter Einbezug der nicht im Hub vertretenen GIZ die Rolle zugeschoben, diesen Schwachpunkt zu beheben. Der erster Entwurf für eine Satzung kam offenbar von der GIZ, die als Auftragnehmer des BMGs die Hub-Geschäftsstelle führt, dieser wurde dann vom Interims-Lenkungskreis diskutiert. Laut früherer Aussage des GHHG wird der Interims-Lenkungskreis auch schlussendlich die Kommentierung und Verabschiedung des Satzungsentwurfs vornehmen.[4]
Dabei wird er sich allerdings nicht auf transparente und faire Verfahrensweisen stützen können – diese werden ja erst in einer Satzung festgeschrieben. Die Auflösung der existenziellen Frage, ob erst die Henne oder das Ei kam, soll offenbar wie folgt „gelöst“ werden: Die Henne legt einfach das Ei, aus dem sie dann schlüpft. Leidtragende ist hier die breite Mitgliederschaft, der eine umfangreiche Mitbestimmung in Aussicht gestellt worden war.
Kommt alles Gute von oben?
Im April kommunizierte das BMG, der Hub habe bereits fast 170 Mitglieder. Die blieben bisher allerdings weitgehend ohne direkten Einfluss, konnten lediglich beim so genannten Global Health Talk Mitte Juni erste Arbeitsgruppen gründen.[5]
Die übergeordneten Schwerpunktthemen hatte das BMG vorsorglich schon beim Start des Hub selbst festgelegt.[6] Auch der erste Lenkungskreis war vorab bestimmt worden. Es hat also schon eine gewisse Tradition, dass die Mitglieder bei den fundamentalen Entscheidungen nur begrenzt mitreden können. Momentan deutet wenig darauf hin, dass sich dies bei Ausarbeitung und Annahme der Satzung ändern könnte. Denn selbst wenn irgendwann noch digitale Rückmeldungen aufgenommen werden, ist momentan völlig unklar, ob und wie genau diese berücksichtigt werden.
Die Möglichkeit einer zeitnahen, ersten Mitgliederversammlung mit Debatte und Abstimmung über einen Satzungsentwurf, der schließlich elementar für die künftige Ausrichtung und Arbeit des Hub ist, wurde offenbar gar nicht ernsthaft erwogen. Für ein Projekt, bei dem Partizipation angeblich groß geschrieben werden sollte, ist dieses Zwischenzeugnis verheerend und wachsender Unmut verständlich. Es steht zu erwarten, dass es für den GHHG noch ein heißer Sommer wird. (MK)
Artikel aus dem Pharma-Brief 4-5/2019, S.4
Bild Henne bunt © luna4 /iStock
[1] welt-sichten (2019) Hype um den Hub. www.welt-sichten.org/artikel/36147/hype-um-den-hub [Zugriff 23.07.2019]
[2] Pharma-Brief (2019) Neues aus dem Nebel. Nr. 2, S. 4-5.
[3] Der Brief ist einsehbar unter https://www.eva-maria-schreiber.de/de/article/217.brief-an-giz-konsultationsprozess-zur-satzung-des-global-health-hubs.html [Zugriff 24.07.2019]
[4] Global Health Hub Germany (2019) Auftaktsitzung Interims-Lenkungskreis Global Health Hub Germany. www.globalhealthhub.de/de/news/auftaktsitzung-interims-lenkungskreis-global-health-hub-germany [Zugriff 23.07.2019]
[5] Global Health Hub Germany (2019) #GlobalHealthTalk2019 – Auftakt für die akteursübergreifende Zusammenarbeit des Global Health Hub Germany. www.globalhealthhub.de/de/news/globalhealthtalk2019-auftakt-fuer-die-akteursuebergreifende-zusammenarbeit-des-global-health [Zugriff 23.07.2019]
[6] Pharma-Brief (2019) Interessengruppen auf den Leim gegangen? Nr. 1, S. 1
Die Geister von Genf
Transparenz bei Forschung weiter auf internationaler Agenda
Nach der viel diskutierten Kontroverse um Transparenz bei Arzneimittelpreisen auf der Weltgesundheitsversammlung im Mai in Genf hält die Debatte an. Im Vorfeld der nächsten UN Vollversammlung zeigen sich abermals alte Konfliktlinien. Welche Rolle wird Deutschland einnehmen?
„Nach dem Spiel ist vor dem Spiel“ – diese Sportlerweisheit gilt momentan auch in der Debatte um verbesserten Zugang zu medizinischer Behandlung. Zwar endete die letzte Weltgesundheitsversammlung in Genf beim Thema Transparenz-Resolution mit einem Paukenschlag und scharfer deutscher Kritik (wir berichteten[1]). Doch nehmen nachfolgende Prozesse den Faden direkt auf
Am 23. September findet in New York im Zuge der UN Vollversammlung das UN High-Level Meeting zu Universal Health Coverage (UHC) statt. Im sehr umfangreichen UHC-Resolutionsentwurf finden sich auch Aussagen zu Transparenz und Forschung. Ein Umstand, der angesichts der zurückliegenden Ereignisse in Genf gerade aus deutscher Perspektive beachtenswert ist.
Ein hartnäckiges Thema
Bis heute zieht sich die Bundesregierung auf den schwachen Einwand zurück, dass das damalige Prozedere bei der Transparenz-Resolution fehlerhaft gewesen sei und man sich deshalb distanziert habe.[2] Eine echte Auseinandersetzung mit der Tatsache, dass sich Deutschland vorher massiv für die Verwässerung und Beschneidung der Inhalte ins Zeug gelegt hatte, fand zumindest öffentlich nicht statt. Nun bildeten jedoch abermalige Debatten um Transparenz und Forschung eine der größten Hürden bei der Vorbereitung des Textes für New York.[3]
Gerungen wurde um mehrere Punkte, ein wichtiger war das Plädoyer für die Erhöhung der Transparenz bei Preisen und Forschungskosten. Hier hatte es bereits bei der Weltgesundheitsversammlung massive Konfrontationen zwischen Mitgliedsstaaten gegeben. Weitere umstrittene Ausführungen setzten sich für verbesserte Förderung alternativer Produktentwicklung ein. Zentral ist hier das Streben, den Produktpreis von den Kosten für Forschung und Entwicklung zu entkoppeln. „De-Linkage“, der verbreitete Begriff für diesen Ansatz, wurde jedoch offenbar absichtlich ausgespart, um Anstoß zu vermeiden. Ein später Entwurf enthielt zudem die Analyse, dass hohe Preise und schlechter Zugang Fortschritte bei UHC anhaltend beeinträchtigen. Auch diese Textstelle blieb umkämpft.[3]
New York ist nicht Genf – oder?
Universal Health Coverage ist ein vielschichtiges Thema, bei dem die Aspekte Transparenz und Forschung nur zwei von vielen sind. Allerdings können sie große Auswirkungen auf den Zugang zu angemessener Gesundheitsversorgung haben, gerade in ärmeren Ländern. So rechnet die WHO damit, dass allein in Afrika jedes Jahr elf Millionen Menschen durch Gesundheitsausgaben in die Armut rutschen.[4] Dabei geht es beispielsweise längst nicht nur um vernachlässigte Infektionskrankheiten, sondern auch verstärkt um nicht-übertragbare Krankheiten. Deutlich sichtbar ist dies etwa bei hochpreisigen Krebsmedikamenten.[5]
Die Bundesregierung wird im September voraussichtlich hochrangig in New York vertreten sein. In Genf hatte sich gezeigt, dass die öffentliche Aufmerksamkeit für die Themen Transparenz und Zugang groß ist und nationale Positionen kritisch, sowie mit Nachdruck hinterfragt werden. Es ist zu hoffen, dass die deutsche Politik daraus Schlüsse gezogen hat und diesmal eine konstruktivere Haltung einnehmen wird. (MK)
Artikel aus dem Pharma-Brief 4-5/2019, S.3
[1] Pharma Brief (2019) WHA: Deutschland auf Distanz zu Transparenz-Beschluss. Nr. 3. S. 1
[2] Dabei ist das Fundament dieser Kritik sehr fraglich. Denn Resolutionsentwürfe können nach WHO-Regularien bis zum ersten Tag der Weltgesundheitsversammlung eingebracht werden, wenn die Resolution auf der Agenda ist. Dies war bei der Transparenz-Resolution der Fall. Es ist zudem nirgendwo vorgegeben, dass Resolutionen zunächst beim Board eingebracht werden müssen, was ebenfalls ein deutscher Beschwerdepunkt war.
[3] Health Policy Watch (2019) Drug R&D, Sexual & Reproductive Health Scrutinised In Draft UHC Declaration. www.healthpolicy-watch.org/drug-rd-sexual-reproductive-health-scrutinised-in-draft-uhc-declaration/ [Zugriff 23.07.2019]
[4] DEVEX (2019) Achieving UHC in Africa requires support for most vulnerable, experts say www.devex.com/news/achieving-uhc-in-africa-requires-support-for-most-vulnerable-experts-say-94411 [Zugriff 24.07.2019]
[5] 't Hoen E et al. (2019) Improving affordability of new Essential Cancer Medicines. Lancet Oncol http://dx.doi.org/10.1016/S1470-2045(19)30459-0
Essenzielle Probleme
Listen unentbehrlicher Arzneimittel sind oft nicht kohärent
Seit über 40 Jahren gibt es die Modelliste für unentbehrliche Arzneimittel der Weltgesundheitsorganisation (WHO). Die meisten Länder der Welt nutzen angepasste nationale Listen für ihre Gesundheitsversorgung. Doch die Auswahl der Wirkstoffe scheint nicht immer optimal. Und die hohen Preise für viele neue Präparate stellen ein ernstes Zugangshindernis dar.
Eine sinnvolle Auswahl an Medikamenten zu treffen, die in einem Gesundheitssystem verfügbar sein sollen, gilt international als Eckpfeiler für eine gute Versorgung. Der Zugang zu unentbehrlichen Arzneimitteln ist als Ziel in den Nachhaltigen Entwicklungszielen (SDGs) der Vereinten Nationen verankert. Nur wenige Länder – darunter auch Deutschland – leisten sich den Luxus, ohne Rücksicht auf den Nutzen (fast) alle Medikamente zu erstatten.
Die alle zwei Jahre aktualisierte Liste unentbehrlicher Arzneimittel der WHO ist ausdrücklich als Modellliste konzipiert. Sie bietet einen Orientierungsrahmen für nationale Listen. Länder sollen sie nach ihren lokalen Bedürfnissen (und finanziellen Möglichkeiten) ergänzen und nicht benötigte Mittel streichen. Auffällig sind aber die extremen Unterschiede bei den Listen, die sich nicht allein durch unterschiedliche Krankheitslast und Budgetbeschränkungen erklären lassen.
ForscherInnen von zwei öffentlichen Einrichtungen in Kanada und Großbritannien[1] haben gemeinsam mit MitarbeiterInnen der WHO die 137 vorhandenen nationalen Listen unter die Lupe genommen.[2] Auf den Listen fanden sich zusammengenommen 2.068 verschiedene Wirkstoffe. Davon tauchten allerdings 1.248 nur in zehn oder weniger nationalen Listen auf.
Die Spannbreite der Wirkstoffe ist groß, von 44 bis fast 1.000 Medikamente umfassen die Listen je nach Land. Dabei sind sie in ärmeren Ländern oft kürzer, es lässt sich aber kein eindeutiger Zusammenhang mit dem Bruttosozialprodukt erkennen. Spitzenreiter ist die Slowakei mit 983 Medikamenten auf ihrer Liste, dicht gefolgt von Syrien mit 964. Das reiche Schweden kommt hingegen mit 289 Wirkstoffen aus.
Auffälliger noch sind die Abweichungen von den 414 Wirkstoffen auf der WHO-Modellliste von 2017.[3],[4] 73 Wirkstoffe fanden sich nur auf 20% aller nationalen Listen wieder. Dagegen fanden sich rund 100 Medikamente auf fast allen Listen (>80%) wieder. Einige Listen weisen eine hohe Ähnlichkeit mit der WHO-Liste auf, d.h. die meisten der für die nationale Liste gewählten Wirkstoffe stehen auch auf der WHO-Liste, die Zahl der zusätzlichen aufgeführten Arzneimittel ist gering. Die höchste Übereinstimmung weist Pakistan mit 93% auf: Von den 373 Medikamenten auf der nationalen Liste finden sich 347 auch in der WHO-Modellliste.
Andererseits gibt es auch eine Vielzahl von Listen mit einer nur geringen Überschneidung mit dem WHO-Modell. Das liegt oft auch an der großen Zahl zusätzlicher Medikamente, die in die nationale Liste aufgenommen wurden. So finden sich von den 707 Medikamenten auf der äthiopischen Liste nur 319 (45%) auf der WHO-Liste wieder. Stärker ist die Abweichung in der oben schon erwähnten langen syrischen Liste, sie stimmt nur zu 32% mit der Modellliste überein.
Ein weiterer Schwachpunkt sind fehlende Aktualisierungen vieler nationaler Listen: Nicht wenige sind bis zu zehn Jahre alt.
Überprüfung notwendig
Die AutorInnen regen eine kritische Überprüfung der Listen auf nationaler Ebene an. Sämtliche Ergebnisse ihrer Untersuchung haben sie in einer leicht durchsuchbaren Datenbank hinterlegt.[5] Als Warnsignal sehen sie Wirkstoffe, die sich weltweit nur auf wenigen Listen finden. Ein Beispiel dafür ist Acarbose, ein sehr wahrscheinlich unwirksames Mittel gegen Diabetes,[6] das in 21 Ländern gelistet ist.[4]
Eine Schwierigkeit scheint die unzureichende Evidenzbasis für etliche nationale Entscheidungen zu sein. Allerdings ist hier die WHO-Modellliste auch kein gutes Vorbild. Die Auswahl basiert weitgehend auf einem ExpertInnenkonsens. Das Selektionsverfahren fällt weit hinter die heute üblichen Standards der Nutzenbewertung von Arzneimitteln zurück, die in vielen Industrieländern angewandt werden.
Preise als Problem
In die neueste WHO-Liste von 2019 wurden zehn neue Krebsmedikamente aufgenommen.[7] Bereits Industrieländer haben mit den hohen Kosten für diese Medikamente zu kämpfen, die Jahrestherapiekosten liegen oft über 50.000 €. Umso wichtiger ist es, dass diese Medikamente in ärmeren Ländern preisgünstig zur Verfügung stehen. Das ist aber oft nicht der Fall und häufig auch ein Grund, warum Medikamente nicht auf die nationalen Listen unentbehrlicher Arzneimittel kommen. Als Beispiel nennen VertreterInnen von NGOs und WissenschaftlerInnen den Wirkstoff Lenalidomid, der gegen das multiple Myelom eingesetzt wird und dieses Jahr auf die WHO-Liste kam.[8] Bis 2016 war Lenalidomid in Südafrika als Generikum verfügbar, die Jahrestherapiekosten betrugen pro PatientIn 2.289 US$. Dann registrierte Celgene sein Markenpräparat in Südafrika, seitdem kostet es 51.000 US$ pro PatientIn und ist deshalb im öffentlichen Gesundheitssektor, der 84% der Bevölkerung versorgt, nicht mehr verfügbar. Die Herstellungskosten für den Wirkstoff werden auf 2,55 US$ für eine Monatsbehandlung geschätzt. In Indien wurde der Patentantrag für Lenalidomid abgelehnt, dort ist das Präparat für rund 2.000 US$ verfügbar – ein Preis, der für viele InderInnen außerhalb ihrer Möglichkeiten liegt.
Das von der Industrie oft vorgebrachte Argument, dass die Forschungskosten die hohen Preise rechtfertigen, ist aus zwei Gründen nicht stichhaltig: Erstens sind PatientInnen, die sich die Medikamente aus Preisgründen nicht leisten können, sowieso kein Markt für die Hersteller. Eine Abgabe zu Herstellungskosten würde also keinen Verlust für die Firmen darstellen. Zweitens steht die Rechtfertigung an sich auf tönernen Füßen: Die WHO hat die Forschungsausgaben für 99 Krebsmedikamente, die zwischen 1989 und 2017 in den USA auf den Markt kamen, mit den erzielten Umsätzen für diese Mittel verglichen. Dabei kamen sie auf einen durchschnittlichen Umsatz von 14,50 US$ für jeden in die Forschung investierten Dollar (einschließlich Kosten für Fehlschläge).[9] Krebsmedikamente sind also ein äußerst lukratives Geschäft. Leider eines das auf Kosten der Armen dieser Welt geht.
Gesundheitsversorgung für Alle ist ein erklärtes Ziel der Vereinten Nationen. Dazu gehört eine rationale Auswahl der verwendeten Medikamente ebenso wie die Senkung der Preise auf ein bezahlbares Maß. (JS)
Artikel aus dem Pharma-Brief 4-5/2019, S.1
Bild Pillen © ironstealth /istock
[1] Centre for Urban Health Solutions, University of Toronto und Centre for Evidence-Based Medicine, University of Oxford
[2] Persaud N et al. (2019) Comparison of essential medicines lists in 137 countries. Bull WHO; 97, p 394
[3] WHO (2017) 20th Essential Medicines List. www.who.int/medicines/news/2017/20th_essential_med-list/en
[4] Bei etlichen Wirkstoffen sieht die WHO eine Äquivalenz innerhalb der Wirkstoffgruppe (in der WHO-Liste mit einem Quadrat markiert). Bei diesen Wirkstoffen wurde in der vorliegenden Untersuchung die Gleichwertigkeit angenommen und die nationale Auswahl wurde in diesem Fall nicht als Abweichung von der WHO-Liste gewertet.
[5] https://global.essentialmeds.org [Zugriff 12.7.2019]
[6] arznei-telegramm (2017) Arzneimitteldatenbank [Zugriff 12.7.2019]
[7] ‚t Hoen E et al. (2019) Improving affordability of new Essential Cancer Medicines. Lancet Oncol http://dx.doi.org/10.1016/S1470-2045(19)30459-0
[8] WHO (2019) 21th Essential Medicines List. https://apps.who.int/iris/handle/10665/325771
[9] WHO (2018) Pricing of cancer medicines and its impacts. Geneva: WHO https://apps.who.int/iris/bitstream/handle/10665/277190/9789241515115-eng.pdf
Pharma-Brief Spezial
Hier finden Sie eine separate Auflistung des Pharma-Brief Spezial. Dies sind Sonderausgaben, die sich auf unterschiedliche Themenschwerpunkte konzentrieren.
Pharma-Brief Archiv
Pharma-Brief Archiv
Unsere Fachzeitschrift Pharma-Brief erscheint acht Mal pro Jahr und bietet gut recherchierte Beiträge rund um das Thema globale Gesundheit. Sie informiert über Zugangsprobleme bei Medikamenten, Arzneimittelrisiken und Nutzenbewertung, mangelnde Transparenz des Arzneimittelmarktes, vernachlässigte Krankheiten, illegale Pharmageschäfte, internationale Gesundheitspolitik und auch über Projekte der BUKO Pharma-Kampagne. Zweimal jährlich erscheint außerdem eine Doppelausgabe mit dem Pharma-Brief Spezial als Beilage. Die Broschüren beleuchten jeweils ein Schwerpunktthema.
Abonnieren Sie den Pharma-Brief und bleiben Sie auf dem Laufenden!
Sie können hier alle Jahrgänge des Pharma-Briefes ab 1981 online lesen.