Universitäten lassen Transparenz vermissen
Zum Schutz von PatientInnen müssen die Ergebnisse aller klinischen Studien veröffentlicht werden. Doch eine Untersuchung von europäischen Universitäten zeigt, dass viele diese Verpflichtung schlecht erfüllen. Ein gemeinsamer Bericht von BUKO Pharma-Kampagne, TranspariMED (Vereinigtes Königreich), Test Aankoop (Belgien) und Health Action International (Amsterdam) macht gravierende Defizite deutlich. Untersucht wurden die 30 Universitäten, die die meisten Studien durchführen.[1]
Klinische Studienergebnisse nicht zu melden, hat erhebliche negative Konsequenzen für PatientInnen und die öffentliche Gesundheit. Seit Juli 2014 schreibt die Europäische Union (EU) vor, dass für jede klinische Studie, die im EU Clinical Trials Register eingetragen ist, eine Zusammenfassung ihrer Ergebnisse innerhalb von 12 Monaten nach Studienabschluss (sechs Monate für pädiatrische Studien) im europäischen Studienregister veröffentlichen muss. Diese Regulierung trifft auch auf Studien zu, die vor 2014 abgeschlossen wurden und gilt unabhängig davon, ob die Studienergebnisse bereits in der Fachliteratur publiziert wurden. Das bedeutet, dass klinischen Studien, bei denen die Sponsoren keine Zusammenfassung der Ergebnisse im EU-Register veröffentlichten, gegen die Transparenzverordnung der EU verstoßen.
Die Ergebnisse im Überblick
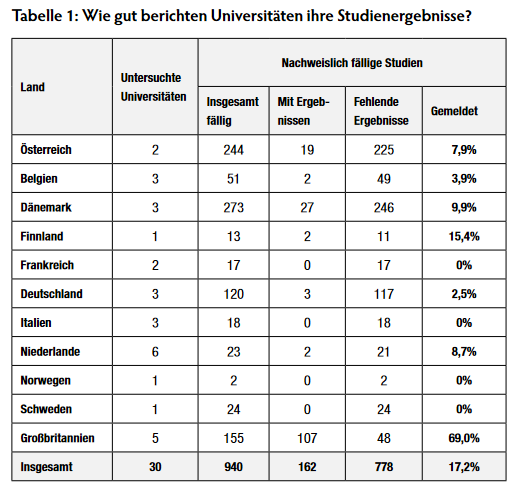
Von den 30 europäischen Universitäten, die die meisten Studien gemeldet haben, fehlen insgesamt nachweisbar Ergebnisse von 778 fälligen klinischen Studien im europäischen Studienregister, das entspricht 83% (Tabelle 1). Lässt man die Universitäten im Vereinigten Königreich außen vor, liegt die Melderate bei lediglich 7%. Die absolute Zahl an fehlenden Ergebnissen von fälligen Studien ist vermutlich deutlich höher.
Nur drei Universitäten schneiden gut ab: University of Oxford, University College London und King’s College London. Diese Einrichtungen haben bereits über 80% ihrer fälligen Studienergebnisse veröffentlicht. 14 der 30 untersuchten Universitäten haben dagegen nicht ein einziges Studienergebnis veröffentlicht. Das trifft auf alle Universitäten in Frankreich, Italien, Norwegen und Schweden zu. Auch die verbliebenen 13 Universitäten schneiden mit Melderaten von 2 – 33% schlecht ab.
Die Tatsache, dass britische Universitäten ihre europäischen Peers mit großem Abstand übertreffen, liegt am Druck des Parlaments, der Forschungsförderer und der Öffentlichkeit. Die starke Performance einiger Universitäten im Vereinigten Königreich zeigt, dass Universitäten in ganz Europa es deutlich besser machen können – und auch müssen.
Empfehlungen
Universitäten sollten die Ergebnisse von allen klinischen Studien – vergangene, gegenwärtige und zukünftige – in allen Registern veröffentlichen, in denen die Studien eingetragen wurden. Bei laufenden und künftigen Studien sollten Universitäten die Ergebnisse innerhalb von zwölf Monaten nach Abschluss veröffentlichen.
Darüber hinaus sollten die Universitäten die gemeinsame Erklärung der International Clinical Trials Registry Platform (ICTRP) der Weltgesundheitsorganisation (WHO)[2] unterzeichnen und die dort beschriebenen Regeln zu Transparenz befolgen.
Nationale Zulassungsbehörden sollten regelmäßig den Status aller Studien überprüfen, die in ihren Registern noch als „laufend“ gelistet sind, und ihren Status – falls erforderlich – in „abgeschlossen“ ändern.
Nationale Forschungsförderer sollten ebenfalls die gemeinsame Erklärung der WHO unterzeichnen, um PatientInnen zu schützen und zu verhindern, dass von SteuerzahlerInnen finanzierte medizinische Forschung wegen Nichtveröffentlichung der Ergebnisse der Studien verschwendet werden.
Nationale Regierungen sollten systematisch kontrollieren, ob klinische Studien, die in ihrem Zuständigkeitsbereich durchgeführt werden, ihre Studienergebnisse in öffentlichen Registern innerhalb von zwölf Monaten veröffentlichen, wie es die Best Practices der WHO vorsehen. Studiensponsoren, die ihre Ergebnisse nicht innerhalb der Frist veröffentlichen, sollten sanktioniert werden. Das Vereinigte Königreich bereitet entsprechende Schritte gegenwärtig vor.
Wie gut sind die Länder?
Dieser Bericht untersucht das Meldeverhalten von den 30 europäischen Universitäten mit den klinischen Studien, die der EU-Verordnung zu klinischen Studien unterliegen. Insgesamt haben diese Universitäten 4.575 klinische Studien gesponsert. Für 940 dieser Studien sind Ergebnisse nachweislich fällig. Allerdings haben lediglich 162 der nachweisbar fälligen Studien (17%) ihre Ergebnisse im EU Clinical Trials Register veröffentlicht. Bei den verbleibenden 778 Studien (83%) verstoßen die Universitäten somit gegen die Transparenzvorschriften der EU.
Die meisten der 778 Studien mit nachweislich fehlender Ergebnisberichterstattung wurden von Universitäten in Dänemark (246 Studien), Österreich (225) und Deutschland (117) durchgeführt. Von den untersuchten Universitäten in Frankreich, Italien, Norwegen und Schweden wurde kein einziges Studienergebnis im Register veröffentlicht. Manche Universitäten in Belgien, Deutschland und den Niederlanden haben ebenfalls für keine ihrer klinischen Studien Ergebnisse veröffentlicht. Nur ein paar britische Universitäten haben gut abgeschnitten, manche Institutionen rühmen sich mittlerweile mit Melderaten über 80%. Schließt man die britischen Universitäten von der Betrachtung aus, liegt die durchschnittliche Melderate in Europa gerade mal bei 7% und somit sogar niedriger als die 11%, die Forscher für europäische Universitäten im September 2018 ermittelt haben. Außerhalb des Vereinigten Königreichs fehlen Ergebnissen zu 730 von 785 nachweisbar fälligen Studien (93%).
In Deutschland
Von den einbezogenen drei deutschen Universitäten schneidet München mit 7% noch am besten ab, die Charité kommt auf 2% und Heidelberg hat kein einziges Ergebnis veröffentlicht. Positiv sticht in Deutschland nur die Uni Münster ab, die nicht unter den Top 30 Forschungsstätten ist (und deshalb in die vorliegende Untersuchung nicht mit einbezogen wurde). Sie hat 58,8% aller Studien veröffentlicht.[3]
Die obenstehenden Zahlen unterschätzen vermutlich signifikant den wahren Anteil an klinischen Studien, die wegen fehlender Veröffentlichung der Ergebnisse gegen die EU Regeln verstoßen. Das liegt daran, dass zahlreiche Studien als „laufend“ im europäischen Studienregister gelistet werden, obwohl sie schon längst abgeschlossen sind. Zum Beispiel haben Universitäten in den Niederlanden insgesamt 967 Studien durchgeführt, aber nur 23 davon (2,4%) sind als „abgeschlossen“ gekennzeichnet. Dieser geringe Anteil ist nicht plausibel, da die Registereinträge zeigen, dass viele dieser Studien vor über fünf Jahren begonnen wurden. Im Vereinigten Königreich, wo das nationale Register gerade aktualisiert wird, liegt der Anteil der „abgeschlossenen“ Studien bei 27,4%.
Im aktuellen Meldesystem laden die Universitäten direkt ihre zusammengefassten Ergebnisse in das EU Register hoch – als Studiensponsoren sind sie rechtlich dazu verpflichtet und der Prozess liegt komplett in ihrer eigenen Kontrolle. Allerdings können Universitäten nicht direkt den Status ihrer Studien (laufend, abgeschlossen) aktualisieren. Stattdessen müssen sie ihre nationale Zulassungsbehörde darüber informieren, dass eine Studie abgeschlossen ist. Die Behörde aktualisiert dann den Status der Studie im Register. In Ländern mit unerklärlich niedrigen Anteilen an „abgeschlossenen“ Studien, wie die Niederlande, ist es sehr wahrscheinlich, dass die nationalen Behörden eine große Zahl von Registereinträgen nicht geändert haben, obwohl die Studien abgeschlossen waren. Diese Behörden sollten dem positiven Beispiel der britischen MHRA folgen, und systematisch den Status aller klinischen Studien, die in ihrem Land durchgeführt wurden, durchsehen und aktualisieren.
Warum sind britische Universitäten besser?
Im Durchschnitt schneiden die britischen Universitäten deutlich besser ab als die in anderen Ländern. Die schwächste der fünf untersuchten Universitäten im Vereinigten Königreich hat eine Melderate von nur 25%, die zwei Stärksten – University of Oxford und King’s College London – haben bisher schon über 90% der fälligen Studienergebnisse veröffentlicht. Zum Vergleich: von einer Ausnahme abgesehen, hat nicht eine einzige Universität des europäischen Festlands eine höhere Melderate als 20%.
Britische Universitäten haben in Sachen Transparenz eine Führungsposition in Europa eingenommen. Ursache dafür war der Druck des Parlaments, der Forschungsförderer und der Öffentlichkeit.
Druck vom Parlament
Das Science and Technology Committee des britischen Parlaments hat 2018 -2019 eine Untersuchung zu wissenschaftlicher Integrität durchgeführt. Mitglieder des Ausschusses waren schockiert, als sie herausfanden, dass zahlreiche Universitäten regelmäßig gegen die Transparenzregeln verstoßen. Anfang 2019 warnte der Vorsitzende des Ausschusses die britischen Universitäten mit einem Schreiben, dass sie vor den Ausschuss zitiert würden und sich rechtfertigen müssten, wenn sie die fehlenden Studienergebnisse nicht bis Sommer 2019 in das Register einstellten.[4]
Druck von den Forschungsförderern
Die zwei öffentlichen medizinischen Forschungsförderungsorgane im Vereinigten Königreich, das NIHR und der MRC, sowie der private Wellcome Trust haben 2017 die gemeinsame Erklärung der WHO zur Veröffentlichung von Studienergebnissen2 unterzeichnet. Mit ihrer Unterschrift verpflichten sich die Forschungsförderer, die Regeln zur Studienregistrierung und Ergebnismeldung gemäß der WHO Best Practices zu befolgen und zu kontrollieren, ob die geförderten Projekte diese Regeln befolgen. Der MRC hat bereits ein exzellentes Review zu den von ihm geförderten klinischen Studien durchgeführt.[5] In den folgenden Jahren könnten britische Universitäten, die es versäumen ihre Studienergebnisse rechtzeitig in den Registern zu veröffentlichen, von weiteren Förderungen ausgeschlossen werden.
Öffentlicher Druck
Eine von TranspariMED initiierter loser Zusammenschluss von Gruppen, die sich um Integrität in der Gesundheitsversorgung kümmern, darunter Universities Allied for Essential Medicines (UAEM-UK), HealthWatch UK, Transparency International Health und STOPAIDS, hat sich an das Parlament gewendet, die Medien informiert und Druck auf die Universitäten ausgeübt, um eine bessere Meldepraxis für Studienergebnisse zu erreichen.
TranspariMED und UAEM-UK haben zudem mehrere Berichte zur Leistung einzelner britischer Universitäten veröffentlicht.[6] Zeitgleich hat sich die hauptsächlich in Großbritannien aktive AllTrials Kampagne[7] des Problems angenommen, unter anderem mit regelmäßigen E-Mails an ihre über 90.000 Unterstützer. Das EBM Data Lab der University of Oxford hat den EU Trials Tracker konzipiert, von dem die Daten für den vorliegenden Bericht stammen. Das EBM Data Lab arbeitet mit der AllTrials Kampagne zusammen und hat dem Parlamentsausschuss mit den notwendigen Daten zur Veröffentlichungspraxis von klinischen Studien der Universitäten versorgt.
Der gebündelte Druck hatte einen enormen Einfluss auf das Meldeverhalten der britischen Universitäten. Das King’s College London beispielsweise hat innerhalb nur eines halben Jahres seine Melderaten von 18% auf 93% verbessert. Die University of Nottingham, die vom Parlamentsausschuss 2018 wegen ihrer schlechten Leistung angeprangert wurde, hat inzwischen die Ergebniszusammenfassungen zu über 95% der von der Uni durchgeführten Studien veröffentlicht.
Soweit TranspariMED das beurteilen kann, arbeitet momentan jede medizinische Universität im Vereinigten Königreich hart daran, fehlende Studienergebnisse im EU Register hochzuladen und oftmals sogar in anderen Registern, wie das ISRCTN und das US Register Clinicaltrials.gov. Dadurch wird deutlich, dass wo ein Wille ist, auch ein Weg ist – andere Universitäten in Europa können also ebenfalls die Probleme lösen, wenn sie wollen. (Siehe Artikel zur Nottingham University auf S. 10.)
Momentan arbeitet die britische Regierung daran, ein umfassendes nationales Monitoringsystem für klinische Studien einzuführen. Es soll jede einzelne klinische Studie, die auf britischem Boden durchgeführt wird, nachverfolgen, einschließlich kommerzieller und länderübergreifender Studien. Damit soll sichergestellt werden, dass alle Studien registriert und ihre Ergebnisse veröffentlicht werden.
Relevanz für die Praxis
Da Verschweigen von Studienergebnissen ist kein Kavaliersdelikt. Ein Bericht von 2017 von Transparency International und Cochrane zeigt, dass es fehlende Ergebnisberichte von Studien gravierende negative Konsequenzen haben können:[8] Patienten geraten durch falsche Behandlungsentscheidungen in Gefahr, öffentliche Einrichtungen können keine informierten Entscheidungen über den Nutzen von Arzneimitteln treffen, öffentliche Gelder werden verschwendet und der medizinische Fortschritt wird verlangsamt.
Rechtliche Rahmenbedingungen
Eine EU-Verordnung schreibt seit Juli 2014 vor, dass eine Zusammenfassung der Ergebnisse für jede einzelne Studie, die im EU Studienregister EudraCT eingetragen ist, innerhalb von zwölf Monaten (bei pädiatrischen Studien sechs Monate) nach Studienabschluss veröffentlicht werden muss. Das bedeutet, dass alle in diesem Bericht ermittelten klinischen Studien, bei denen eine Zusammenfassung der Ergebnisse fehlt, gegen die Transparenzverordnung der EU verstoßen. Sie wurde eingeführt, um die Interessen der PatientInnen und SteuerzahlerInnen zu schützen.
Verschwendete Forschung
Ungemeldete Studien hemmen den Fortschritt in der Wissenschaft, schaden der öffentlichen Gesundheit und sind daher eine Verschwendung von Forschungsgeldern. In der Vergangenheit haben das Verschweigen der Ergebnisse von klinischen Studien zum Tod unzähliger PatientInnen und Verluste im Wert von Milliarden Euros verursacht.[9] Aus diesem Grund hat die Erklärung von Helsinki das Melden von Ergebnissen jeder klinischen Studie zu einer universeller ethischen Pflicht für alle medizinischen ForscherInnen weltweit erklärt.[10]
Nicht alle Studien, die ihre Ergebnisse nicht im EU Studienregister eingetragen haben, sind komplett unveröffentlicht. Jedoch weist die bestverfügbare Evidenz darauf hin, dass etwa von der Hälfte aller Studien, deren Ergebnisse im EU Register fehlen, auch nicht in Fachzeitschriften veröffentlicht wurden. Dadurch geraten Hunderte von Studien an europäischen Universitäten in Gefahr, eine Verschwendung von Forschungsgeldern zu werden, werden ihre Ergebnisse nicht bald veröffentlicht.
Universitäten müssen dringend ihre klinischen Studien im EU-Register, dem US-Register clinicaltrials.gov und anderen WHO Primärstudienregistern durchsehen, ungemeldete Studien identifizieren und sicherstellen, dass fehlende Eintragungen nachgeholt und die Ergebnisse einer Studie so bald wie möglich nach deren Abschluss veröffentlicht werden.
Global Best Practices
Die WHO Standards schreiben vor, dass die Ergebnisse jeder Interventionsstudie in jedem öffentlichem Register, in dem sie eingetragen sind, zwölf Monate nach Abschluss der Studie veröffentlicht werden. Die WHO hebt hervor, dass die Veröffentlichung von Studienergebnissen in der Fachliteratur kein Ersatz zur Meldung der Ergebnisse in öffentlichen Registern darstellt.
Best Practices, die gemeinsam von Cochrane und Transparency International entwickelt wurden, sehen ebenfalls vor, dass „eine Zusammenfassung der Ergebnisse für alle klinischen Studien in den Registern, in denen sie ursprünglich registriert wurden, innerhalb von zwölf Monaten nach Studienabschluss hochgeladen werden muss.“8 Beide Organisationen machen darauf aufmerksam, dass das nachträgliche Hochladen der Ergebnisse von allen vergangenen Studien in den Registern „die Gesundheitsversorgung und die Entscheidungsfindung von Regierungseinrichtungen zur Ressourcenverteilung verbessern würde, und gleichzeitig würden Milliarden von Dollar für medizinische Forschung davor bewahrt, für immer verloren zu sein.“
Übereinstimmend damit fordert die AllTrials Kampagne, dass „eine Zusammenfassung der Ergebnisse […] dort wo die Studie registriert wurde innerhalb eines Jahres nach Studienabschluss hochgeladen werden sollte.“
Es gibt gute Gründe dafür, dass alle Studienergebnisse in den Registern veröffentlicht werden sollten. Das Hochladen der Ergebnisse in den Registern beschleunigt den medizinischen Fortschritt, denn durch die 12-Monatsfrist können Ergebnisse deutlich schneller geteilt werden. Der Veröffentlichungsprozess in der Fachliteratur ist viel langwieriger.
Das Risiko, dass die Ergebnisse einer Studie nie veröffentlicht werden und eine Verschwendung von Forschung darstellen, wird minimiert. Das kann sonst zum Beispiel passieren, wenn der Studienleiter während des langwierigen Prozesses einer wissenschaftlichen Veröffentlichung stirbt oder seine Stelle wechselt.
Forschung hat ergeben, dass Studienergebnisse, die in Register hochgeladen wurden, üblicherweise ein verständlicheres und genaueres Bild der Ergebnisse, die für PatientInnen relevant sind, geben als wissenschaftliche Publikationen. Studienergebnisse in den Registern sind einfacher aufzufinden und öffentlich zugänglich. Das Melden in Registern vereinfacht es, die Studienergebnisse mit den ursprünglich festgelegten Zielen zu vergleichen. Somit werden schädliche Verletzungen der Sorgfaltspflicht in der Forschung, wie das „stille“ Zurückhalten unvorteilhafter Ergebnisse, Hinzufügen oder Ändern der ursprünglich festgelegten Endpunkte,[11] selektives Berichten von für den Sponsor günstigen Ergebnissen und Praktiken wie HARKing[12] und p-hacking,[13] weniger wahrscheinlich.[14]
Falsche Vorwände
Das International Committee of Medical Journal Editors befürwortet das Hochladen von Studienergebnissen in Studienregistern und betont, dass das nicht als Vorveröffentlichung eines Artikels betrachtet wird. Das bedeutet, dass wissenschaftliche Zeitschriften Artikel akzeptieren, auch wenn die Ergebnisse zuvor im Studienregister veröffentlicht wurden.[15] Da das Melden der Ergebnisse in den Registern üblicherweise schneller ist als eine wissenschaftliche Publikation, ist es nun Best Practice für wissenschaftliche Kommunikation, die Studienergebnisse in Registern zu veröffentlichen, bevor sie in der Fachliteratur erscheinen.
Der vorliegende Text wurde ursprünglich von Till Bruckner verfasst, von Hannah Eger übersetzt und von Jörg Schaaber überarbeitet. c Er unterliegt wie das Original [16] einer Creative Commons BY 3.0 Lizenz.
Artikel aus dem Pharma-Brief 4-5/2019, S.5
Bild window cleaning © Vikramjit Kakati
[1] Die Untersuchung wurde von Till Bruckner (TranspariMED) durchgeführt. Der vorliegende Text ist eine überarbeitete und leicht gekürzte Fassung des englischen Originals.
[2] WHO (2017) International Clinical Trials Registry Platform (ICTRP) Joint statement on public disclosure of results from clinical trials www.who.int/ictrp/results/jointstatement/en
[3] http://eu.trialstracker.net/sponsor/university-of-munster
[4] Bruckner T (2019) UK government promises national strategy to boost clinical trial reporting. 25 Feb. www.transparimed.org/single-post/2019/02/25/UK-government-promises-national-strategy-to-boost-clinical-trial-reporting
[5] MRC (2017) MRC Review of Clinical Trials. https://mrc.ukri.org/research/policies-and-guidance-for-researchers/review-of-clinical-trials
[6] www.transparimed.org/resources
[8] TI (2017) Clinical trials transparency https://docs.wixstatic.com/ugd/01f35d_def0082121a648529220e1d56df4b50a.pdf
[9] Bruckner T and Ellis B (2017) Clinical Trial Transparency https://media.wix.com/ugd/01f35d_0f2955eb88e34c02b82d886c528efeb4.pdf
[10] WMA (2019) Declaration of Helsinki www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects
[11] Altman DG et al. (2017) Harms of outcome switching in reports of randomised trials: CONSORT perspective. BMJ;356, p j396
[12] HARKing = Hypothesizing after the results are known. Neue Hypothesen aufstellen, wenn man die Ergebnisse schon kennt
[13] p-hacking. So lange mit den Daten spielen, bis das statistische Signifkanzniveau (p-Wert) doch noch erreicht wird. Üblicherweise gilt ein p-Wert unter 0,05 als signifikant (das Ergebnis ist dann zu 95% nicht zufällig)
[14] Munafò MR et al. (2017) A manifesto for reproducible science. Nature Human Behaviour; 1, article number 0021 www.nature.com/articles/s41562-016-0021
[15] ICMJE (2019) Clinical Trials www.icmje.org/recommendations/browse/publishing-and-editorial-issues/clinical-trial-registration.html [Zugriff 24.7.2019]
[16] www.bukopharma.de/images/pressemitteilungen/2019/Clinical_Trial_Transparency_EU_Universities_2019.pdf