Nutzen von Antidepressiva überschätzt, weil Publikationen fehlen
Seit über zehn Jahren ist es bekannt: Anbieter lassen bei Medikamenten gegen Depressionen unvorteilhafte Studienergebnisse gern unter den Tisch fallen. Dadurch entsteht ein zu positives Bild der Wirksamkeit. Hat sich die Lage inzwischen gebessert?
Vernünftige Entscheidungen über die beste individuelle Therapie sind ohne vollständigen Einblick in die Fakten schwierig. Erfahren ÄrztInnen wirklich alle relevanten Fakten über Medikamente? Der Psychiater Erick Turner und seine KollegInnen machten sich 2008 auf die Spurensuche und nahmen zwölf Antidepressiva unter die Lupe, die in den Jahren davor in den USA auf den Markt gekommen waren. Sie verglichen die Bewertung des Nutzens durch die Zulassungsbehörde Food and Drug Administration (FDA) mit den Aussagen über dieselben Studien in Fachzeitschriften, aus denen praktisch tätige MedizinerInnen ihr Wissen über neue Medikamente beziehen. Turner & Co. stießen auf eine große Informationslücke.
Während die FDA nur rund die Hälfte der 74 eingereichten klinischen Studien als Wirksamkeitsbelege wertete, entstand in der Fachpresse der Eindruck, dass 94 Prozent der Studien positiv ausgegangen seien.[1]
Wie konnte eine so große Differenz in der Wahrnehmung entstehen? Bei der Hälfte der Studien hatte das Medikament nicht besser als ein Placebo abgeschnitten, aber nur bei elf Prozent wurde über dieses Ergebnis korrekt berichtet. Die meisten Studien kamen gar nicht ans Licht der Öffentlichkeit, bei anderen wurden die Ergebnisse einfach uminterpretiert.
Antidepressiva: Wissen wir jetzt mehr?
Jetzt kommt vom selben AutorInnenteam ein Update.[2] Es hat sich dafür die Dokumentationen von vier neueren Antidepressiva angeschaut, für die der FDA 30 Studien vorlagen. Wesentliche Ergebnisse blieben gleich: Wieder schnitten in Kenntnis aller Daten bei der Hälfte der Studien die Wirkstoffe nicht besser als ein Placebo ab. Und Berichte über alle positiven Studien fanden sich in der Fachpresse.[3] Immerhin wurden jetzt 47 Prozent der negativen Studien korrekt veröffentlicht, gegenüber nur elf Prozent in der Analyse von 2008.
Dabei gab es aber deutliche Unterschiede zwischen den einzelnen Wirkstoffen: In der neuen Analyse wurden für zwei der vier Präparate sämtliche Studien veröffentlicht, egal ob positive oder negative Ergebnisse vorlagen.
Bei den beiden anderen Medikamenten hingegen fehlten für acht von 15 negativen Studien korrekte Veröffentlichungen: Für sechs gab es gar keinen Artikel, und die Ergebnisse zu zwei Studien wurden in einer zusammenfassenden Veröffentlichung falsch dargestellt. Sie waren dort nur gemeinsam ausgewertet worden, um ein besseres Ergebnis vorzutäuschen. Da auch mit diesem Trick die Wirksamkeit immer noch nicht eindeutig belegt werden konnte, wurde auch noch die Analysemethode nachträglich gezielt geändert, um Vorteile vorzutäuschen.
Während 2008 noch elf Studien mit negativem Ausgang in den Veröffentlichungen zu positiven Ergebnissen umgeschrieben wurden, sind verzerrende Darstellungen laut Update mit nur noch zwei falsch berichteten Studien seltener geworden.
Was sich geändert hat
Diese Verbesserungen geschahen aber nicht freiwillig, sondern sind vermutlich das Ergebnis von regulatorischen Eingriffen, die für mehr Transparenz sorgen sollen. Den Anfang machte die Schaffung eines öffentlichen Registers für klinische Studien in den USA, die im Jahr 2000 unter dem Namen
ClinicalTrials.gov online ging. Sie machte es schwerer, die Existenz von Studien zu verschweigen. 2004 verkündeten die HerausgeberInnen der größten medizinischen Fachzeitschriften, keine Artikel über Studien mehr zu publizieren, wenn diese nicht registriert sind. 2007 wurde durch ein Gesetz in den USA die Eintragung von Studien in das Register verpflichtend. Auch der öffentliche Druck, der durch mehrere Publikationen zum Thema „Unterschlagen von unvorteilhaften Ergebnissen“ entstanden ist, hat sicher geholfen.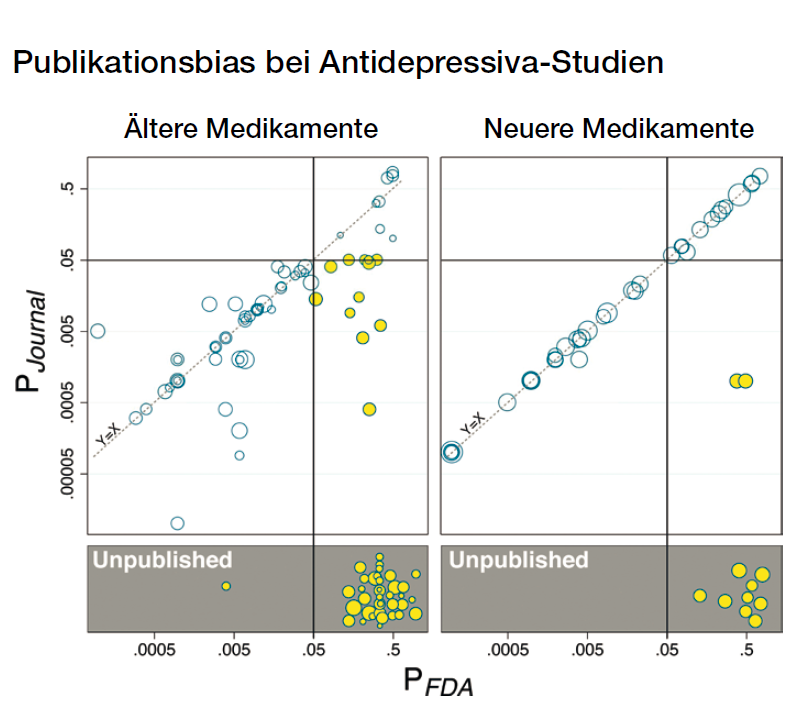
Turner & Co. warnten trotz der Fortschritte vor übertriebener Euphorie. Das Glas sei mit Verschweigen der Hälfte der negativen Studien immer noch halbleer, in der Gesundheitsversorgung sei nur die ganze Wahrheit akzeptabel. Wenn der Nutzen von Antidepressiva überschätzt wird, unterbleiben womöglich andere wirksame, medikamentenfreie Behandlungen wie zum Beispiel Psychotherapien. (JS)
Eine Vorfassung dieses Artikels erschien in „Gute Pillen – Schlechte Pillen“ 4-2022.
Artikel aus dem Pharma-Brief 5-6/2022, S. 4
Die Grafik zeigt den Publikationsbias anhand der Signifikanzschwelle, dem P-Wert von 0,05 = .05 (durchgezogene Linien). Links die älteren Ergebnisse von 2008 (12 Antidepressiva, 101 Untersuchungsarme*) und rechts die neueren Ergebnisse von 2022 (4 Antidepressiva, 48 Untersuchungsarme).
Jeder Kreis stellt eine Studie dar, die Größe ist proportional zur TeilnehmerInnenzahl. Wenn es keinen Unterschied zwischen der Einschätzung der FDA (waagerechte Achse) und der Studienveröffentlichung (senkrechte Achse) gibt, befindet sich der Kreis auf der gestrichelten diagonalen Linie.
Im grauen Bereich unter der vergleichenden Grafik sind die unpublizierten Studien dargestellt, hier gibt es logischerweise keinen Vergleich mit der Veröffentlichung.
Gelb markiert sind die Studien, wo sich die Einschätzung der FDA so weit von der Studienveröffentlichung abweicht, dass die Signifikanz verloren geht und alle unveröffentlichten Studien. Alle gelben Kreise stehen also für eine für Außenstehende nicht erkennbare Verzerrung der Wahrnehmung zugunsten der Medikamente.
Quelle: Turner 2022 https://doi.org/10.1371/journal.pmed.1003886.g001
* Die Studien machten teilweise mehr als einen Vergleich, also nicht nur Wirkstoff gegen Placebo, sondern auch noch gegen einen anderen Wirkstoff oder gegen unterschiedliche Dosen desselben Wirkstoffs. das erklärt, warum es mehr Studienarme als Studien gibt.
[1] Turner EH et al. (2008) Selective Publication of Antidepressant Trials and Its Influence on Apparent Efficacy. N Engl J Med; 358, p 252 https://doi.org/10.1056/NEJMsa065779
[2] Turner EH et al. (2022) Selective publication of antidepressant trials and its influence on apparent efficacy. PLoS Med; 19, p e1003886 https://doi.org/10.1371/journal.pmed.1003886
[3] In der ersten Untersuchung von 2008 waren von 37 positiven Studien alle bis auf eine veröffentlicht worden.

