Nutzenbewertung in Deutschland: Die Spreu vom Weizen trennen
Erfolgsmodell mit kleinen Schönheitsfehlern
Seit zehn Jahren wird bei allen neuen Medikamenten in Deutschland geprüft, ob sie PatientInnen tatsächlich besser helfen als die bislang verwendeten. Zeit für eine Bilanz.
Am 1. Januar 2011 trat das Arzneimittelmarktneuordnungsgesetz – kurz AMNOG – in Kraft. Hinter dem Wortungetüm steht ein klarer Auftrag: die systematische Prüfung des Nutzens aller Neueinführungen auf dem deutschen Arzneimittelmarkt. Das Gesetz verfolgt zwei Ziele: die Versorgung zu verbessern und die Krankenversicherung finanzierbar zu halten.
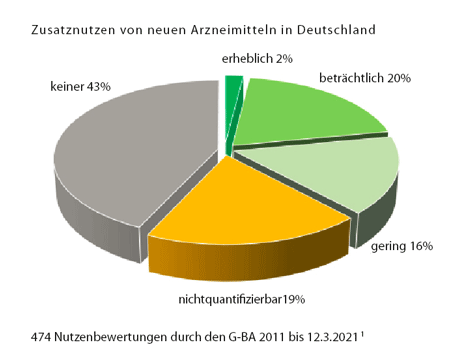
Die wichtigste Erkenntnis aus beinahe 500 Bewertungen (siehe Grafik auf S. 3):[1] Fast die Hälfte der neuen Medikamente (43%), die in den letzten zehn Jahren neu auf den Markt gekommen sind, bieten den PatientInnen keine Vorteile im Vergleich zu der bisher üblichen Behandlung. Gerade einmal 2% sind tatsächlich therapeutische Durchbrüche, immerhin 20% bringen beträchtliche Vorteile, aber 16% sind nur geringfügig besser. Problematisch ist der hohe Anteil der Medikamente mit unklarem Zusatznutzen (19% „nicht quantifizierbar“): Hier ist die Datenlage dermaßen unklar, dass man noch gerade erkennen kann, dass es vermutlich Vorteile gibt, aber sie unmöglich quantifizierbar sind.
All dies bietet jedoch ein zu rosiges Bild. Die genannten Zahlen beziehen sich auf die beste Bewertung eines Wirkstoffs. Häufig bieten neue Medikamente aber nicht allen Erkrankten Vorteile. Wenn die Urteile auf die unterschiedlichen PatientInnengruppen heruntergebrochen werden, findet sich bei rund 60% kein Zusatznutzen.
Dazu kommt: Medikamente gegen seltene Krankheiten (Orphan Drugs)[2] bekommen ohne Prüfung einen Zusatznutzen bescheinigt, solange sie die Krankenversicherung nicht mehr als 50 Millionen Euro pro Jahr kosten. Hier kann der Zusatznutzen also völlig fiktiv sein. Er ist gesetzlich vorgeschrieben, statt auf einer wissenschaftlichen Bewertung zu beruhen. Diese juristisch bedingte Bevorzugung betrifft jede fünfte Bewertung.[3]
Schlechte Studien
Vor allem bei den Waisenmedikamenten ist die Studienlage oft unbefriedigend. Die Zahl der untersuchten PatientInnen ist nicht selten unnötig klein oder die Dauer der Studien zu kurz, was sichere Aussagen über den Nutzen unmöglich macht. Es gibt oft keine Vergleiche gegen andere Behandlungsstrategien, obwohl sie vorhanden sind. Und mitunter wird gar nicht gemessen, was für die Betroffenen tatsächlich spürbare Verbesserungen bringt. Aufgrund dieser Unsicherheiten machen Waisenmedikamente den Löwenanteil der Medikamente mit nicht quantifizierbarem Zusatznutzen aus.
Allerdings wird auch bei anderen neuen Wirkstoffen allzu oft kein direkter Vergleich zu existierenden Medikamenten gemacht. Dadurch ist es fast unmöglich zu beurteilen, ob die Neuerung tatsächlich einen Vorteil bietet. Während sich die Hersteller zu Anfang des AMNOGs noch darauf berufen konnten, dass die Nutzenbewertung viel zu neu sei und die Zulassungsbehörden sich doch mit dem Vergleich gegen Placebo zufriedengegeben hätten, zieht dieses Argument heute nicht mehr – es wird von den Firmen aber trotzdem immer noch bemüht. Ein Trend zu mehr direkt vergleichenden Studien ist leider nicht zu erkennen. Insofern vergoss der Chef des Pharmaverbandes Vfa kürzlich Krokodilstränen, als er beklagte, dass fast die Hälfte der Studien vom G-BA für die Nutzenbewertung nicht berücksichtigt würde.[4] Das liegt nämlich einfach daran, dass sie dafür schlicht ungeeignet sind. Über die Jahre liegen für rund die Hälfte der neuen Medikamente keine direkten Vergleiche zum bisherigen Therapiestandard vor.[5]
Ein Problem sind auch die oft verfrühten Zulassungen bei noch gar nicht abgeschlossenen Studien. Solche Zwischenauswertungen lassen die Neuerungen manchmal in einem zu positivem Licht erscheinen. Zwei krasse Fälle betrafen zwei Krebsmedikamente, die vom G-BA einen Zusatznutzen zugesprochen bekamen. Später stellte sich heraus, dass der Wirkstoff Olaratumab unwirksam ist[6] und Ingenolmebutat Hautkrebs sogar häufiger macht.[7] Beide Mittel wurden verboten.
Her mit den Daten
Deutschland war mit der Einführung einer Nutzenbewertung spät dran. Andere europäische Staaten haben einen solchen Realitäts-Check schon seit vielen Jahren. Dafür bietet das deutsche Gesetz aber einen bedeutsamen Vorteil im Vergleich zu unseren Nachbarländern. Es verpflichtet nämlich den Anbieter, die vollständigen Studiendaten zu seinem Produkt zur Bewertung einzureichen, also auch den Teil, der gewöhnlich selbst für die Fachwelt unsichtbar bleibt.
Um sich ein Bild von solchen Geheimniskrämereien zu machen, ein Vergleich: Aus allen öffentlichen Quellen zusammengenommen[8] sind gerade einmal gut die Hälfte aller Studienergebnisse verfügbar, im AMNOG-Verfahren sind es dagegen nahezu 90%.[9] Das erlaubt eine viel fundiertere Einschätzung zum tatsächlichen Nutzen eines neuen Präparats.
Transparenz macht den Unterschied
Dazu ein Beispiel: Während das für England und Wales zuständige NICE dem Brustkrebsmedikament Palbociclib einen Zusatznutzen zusprach, konnte der G-BA keine Vorteile entdecken. Der Unterschied: Bei den Nachbarn lagen nur unvollständige Informationen zu dem Medikament vor. Der Hersteller behauptete, er hätte noch keine Daten dazu, ob die Frauen durch das neue Medikament tatsächlich länger überleben, aber bestimmte Messwerte gäben einen starken Hinweis dafür. Aufgrund der vollständigen Daten konnte in Deutschland demgegenüber errechnet werden, dass kein Überlebensvorteil durch Palbociclib vorhanden war. In England wurden die entscheidenden Angaben für die Bewertung vor der Veröffentlichung der Daten geschwärzt.[10] Es bleibt deshalb unklar, welche Zahlen dem NICE für die Entscheidung vorlagen. Die Begründung der Behörde bezog sich nicht auf einen Überlebensvorteil, sondern lediglich auf die besseren Messwerte, offensichtlich ein Trugschluss.
Verbesserungen angestoßen
In einem Punkt haben die Anbieter durch das Nutzenbewertungsverfahren auf jeden Fall dazugelernt. Während es zu Beginn des AMNOG-Verfahrens nur selten Daten zur Lebensqualität gab, legen heute drei Viertel der Anbieter auch Angaben vor, ob sich die PatientInnen durch die Behandlung mit dem neuen Präparat auch wirklich besser fühlen. Allerdings geschieht das oft noch halbherzig: Denn wenn die Lebensqualität nur bis zum Zeitpunkt einer Verschlechterung der Erkrankung gemessen wird (also z.B. zum Zeitpunkt, wo sich bei Krebs Metastasen bilden), fehlen wesentliche Informationen. Für die Erkrankten ist es aber sehr wichtig zu wissen, wie gut es ihnen in der verbleibenden Lebensspanne noch gehen mag.
Kräftig gespart
Finanziell hat die Nutzenbewertung die Krankenkassen und damit alle Versicherten deutlich entlastet. Zwar wurde erst nach acht Jahren, 2018, die vom Gesetzgeber angepeilte jährliche Ersparnis von zwei Milliarden Euro erreicht, für 2020 wurden aber durch die ausgehandelten Rabatte schon fast vier Milliarden Euro eingespart. Trotzdem bleiben die rasant steigenden Preise für neue Arzneimittel, die inzwischen bis in den Millionenbereich pro PatientIn reichen, ein Problem.
Was kommt in der Praxis an?
Ein Kritikpunkt am AMNOG-Verfahren ist, dass die detaillierten Erkenntnisse darüber, welche Medikamente für welche Zielgruppen Vorteile bringen, in der Krankenversorgung nicht ankommen. Ein Indiz dafür ist, dass auch neue Medikamente, die keinerlei Zusatznutzen haben, häufig verordnet werden. Damit sich das ändert, hat der Gesetzgeber verfügt, dass die Ergebnisse der Nutzenbewertung auf den Computern in Arztpraxen dargestellt werden müssen. Auch PatientInnen können sich selber schlau machen. Auf den Seiten des IQWiG gibt es verständliche Zusammenfassungen der Vor- und Nachteile von neuen Arzneimitteln.[11]
 Verbesserungen möglich
Verbesserungen möglich
Um die Preisspirale zu durchbrechen, gibt es mehrere Vorschläge. Der wichtigste ist vielleicht die rückwirkende Preisfestsetzung. Denn bislang beginnt der ausgehandelte Rabatt für ein neues Arzneimittel erst nach zwölf Monaten. Auf diese Weise können Anbieter – auch die, die ein Mittel ohne jeden Zusatznutzen auf den Markt bringen – ein Jahr lang kräftig absahnen.
Ein besonderes Problem sind die teuren Krebsmedikamente. Wenn die Vergleichstherapie schon 50.000 € oder mehr kostet, bedeutet ein neues Mittel für den Anbieter selbst dann ein gutes Geschäft, wenn wegen fehlenden Zusatznutzens kein höherer Preis erzielt werden kann.
Ein weiterer Vorschlag betrifft den oft enorm hohen Anfangspreis. Firmen sollen offenlegen, wie viel Geld sie in die Forschung gesteckt haben – und inwieweit ihr Produkt auch auf den Ergebnissen staatlich geförderter Forschung an Universitäten und öffentlichen Instituten beruht.
Auch die Nutzenbewertung sollte in einigen Punkten strenger werden. Der Freibrief für Waisenmedikamente unter 50 Millionen Euro Jahresumsatz muss entfallen, und Arzneimittel, die unter Auflagen zugelassen wurden, sollten immer nur eine befristete Bewertung erhalten.[12] Bei solchen Arzneimitteln kann der G-BA inzwischen vom Anbieter weitere anwendungsbegleitende Studien verlangen, um die Erkenntnislage zu verbessern. Bislang fehlt es aber an Sanktionsmöglichkeiten, wenn diese Auflage nicht erfüllt wird.
Undurchsichtige Expertise
Ein weiterer Schwachpunkt des Verfahrens bleibt voraussichtlich noch länger erhalten: Die Intransparenz bei den an Anhörungen beteiligten ExpertInnen. Sie stellen einen wichtigen Beeinflussungsfaktor bei der Nutzenbewertung dar. Während bei den IndustrievertreterInnen offensichtlich ist, welche Interessen sie vertreten, bleibt bei VertreterInnen von Fachgesellschaften die Verstrickung mit den Anbietern der diskutierten Arzneimitteln undurchsichtig – und nicht wenige pflegen enge Kontakte zu den Firmen. Es müssen bei den Anhörungen zwar detaillierte Erklärungen zu Interessenkonflikten vorgelegt werden, diese sind aber nur in absolut kondensierter Form auf der Website des G-BA einzusehen. So kann die Öffentlichkeit nicht mehr erkennen, dass Professor X zwar offiziell eine Fachgesellschaft vertritt, aber gleichzeitig dem Hersteller als Berater für genau das Produkt dient, über dessen Nutzen gerade diskutiert wird. Als Argument gegen eine vollständige Veröffentlichung wird der Schutz persönlicher Daten vorgebracht. Aber oft hat derselbe Professor gar kein Problem, (einen Teil seiner) Interessenkonflikte in internationalen Fachzeitschriften relativ detailliert anzugeben, weil diese sonst den Artikel schlicht nicht veröffentlichen würden.
Bei allen Fortschritten, die das AMNOG gebracht hat, gibt es also noch einigen Verbesserungsbedarf. (JS)
Eine kürzere Vorfassung dieses Artikels erschien in Gute Pillen – Schlechte Pillen (2021) Nr. 3, S. 18
Screenshot Nutzenbewertung ©Auszug aus dem Pharma-Brief
Grafik Zusatznutzen © www.g-ba.de/service/veranstaltungen/10-jahre-amnog
Artikel aus dem Pharma-Brief 3-4/2021, S.1
[1] G-BA-Tagung „10 Jahre AMNOG“ am 19.3.2021 www.g-ba.de/service/veranstaltungen/10-jahre-amnog
[2] Orphan Drugs (Waisenmedikamente) Arzneimittel gegen Krankheiten, von denen nicht mehr als 5 von 10.000 Menschen betroffen sind
[3] Bewertungen bis 31.12.2019. Storm A (Hrsg.) (2020) AMNOG-Report 2020. S. 215
[4] Han Steutel (Vfa) auf der G-BA-Tagung „10 Jahre AMNOG“ am 19.3.2021
[5] Thomas Kaiser (IQWiG) auf der G-BA-Tagung „10 Jahre AMNOG“ am 19.3.2021
[6] Pharma-Brief (2019) Zu früh ist unzuverlässig. Nr.1, S. 4
[7] Pharma-Brief (2020) Ungesunde Eile. Nr. 2, S. 6
[8] Veröffentlichung in Fachzeitschriften, Bericht der Zulassungsbehörde, Studienregister
[9] Untersucht anhand von 15 AMNOG-Verfahren. Köhler M. u.a. (2015) BMJ; 350, S. h796
[10] Pharma-Brief (2019) Die nächste Schlappe. Nr. 2, S. 6
[11] www.gesundheitsinformation.de/vom-iqwig-bewertete-wirkstoffe.html
[12] Für Orphan Drugs mit bis zu 50 Mio. € Umsatz führt der G-BA selbst eine Teilbewertung durch.
Pharma-Brief 3-4/2021: Nutzenbewertung der Medikamente in Deutschland, Gesundheitsforschung u.v.m.
 Der Pharma-Brief 3-4/2021 bietet als Doppelausgabe ein breites Spektrum an Themen:
Der Pharma-Brief 3-4/2021 bietet als Doppelausgabe ein breites Spektrum an Themen:
Nutzenbewertung in Deutschland: Die Spreu vom Weizen trennen
Erfolgsmodell mit kleinen Schönheitsfehlern
Seit zehn Jahren wird bei allen neuen Medikamenten in Deutschland geprüft, ob sie PatientInnen tatsächlich besser helfen als die bislang verwendeten. Zeit für eine Bilanz. Weiterlesen
Covid-19, trust, and Wellcome
Wie sich die Investitionen der Stiftung in die Pharmabranche mit ihren eigenen Forschungsanstrengungen überlappen
Der Hauptgeldgeber der Gesundheitsforschung profitiert finanziell von der Pandemie; das wirft Fragen zu Transparenz und Verantwortlichkeit auf. Ein Beitrag aus dem BMJ von Tim Schwab. Weiterlesen
Aus aller Welt
- Neue Antibiotika dringend benötigt
- USA: Wie wenig Evidenz darf's sein?
- USA: Sterblichkeit mit Covid-19
- Covid-19: Der Impfstoff ist für alle da?
Download: Pharma-Brief 3-4/2021 [PDF/348 kB]
Grafik Zusatznutzen © www.g-ba.de/service/veranstaltungen/10-jahre-amnog
Läuft wie geschmiert…
Indien: Antibiotika-Hersteller locken mit teuren Geschenken
Pharmafirmen belohnen indische ÄrztInnen mit Geschenken, wenn sie viele Antibiotika verschreiben. Das britische Bureau of Investigative Journalism[1] deckte diese Werbepraktiken gemeinsam mit dem indischen Journalisten Rahul Meesaraganda auf. Der folgende Artikel ist eine gekürzte und leicht bearbeitete Fassung des englischen Originaltextes von Madlen Davies und Ben Stockton.[2]
 Recherchen des britischen Bureau of Investigative Journalism zufolge belohnen die Firmen Abbott und Sun Pharma in Indien die Verschreibung von Antibiotika mit Geschenken. Zielgruppe der Werbemaßnahmen sind vor allem informelle ÄrztInnen ohne anerkannte medizinische Ausbildung. Diese selbsternannten Doktoren behandeln überwiegend arme PatientInnen, die keinen Zugang zum öffentlichen Gesundheitssystem haben.
Recherchen des britischen Bureau of Investigative Journalism zufolge belohnen die Firmen Abbott und Sun Pharma in Indien die Verschreibung von Antibiotika mit Geschenken. Zielgruppe der Werbemaßnahmen sind vor allem informelle ÄrztInnen ohne anerkannte medizinische Ausbildung. Diese selbsternannten Doktoren behandeln überwiegend arme PatientInnen, die keinen Zugang zum öffentlichen Gesundheitssystem haben.
In den meisten indischen Bundesstaaten ist es zwar illegal, Antibiotika an nicht-
registrierte ÄrztInnen zu verkaufen. Dem Gesetz wird jedoch nur selten Geltung verschafft. Außerdem existiert kein Verbot, diese Medikamente bei informellen ÄrztInnen zu bewerben.
Nicht-registrierte ÄrztInnen praktizieren vor allem in abgelegenen ländlichen Regionen Indiens, aber auch in den Slums der Großstädte. Häufig sind sie vor Ort die einzigen Anbieter von Gesundheitsdienstleistungen und der überwiegende Teil der Bevölkerung ist auf ihre Dienste angewiesen. Doch gerade informelle ÄrztInnen tragen durch häufige Fehlverschreibungen und den exzessiven Gebrauch von Antibiotika in besonderem Maß zur Resistenzbildung bei. Resistente Erreger sind indes ein immenses Problem: Laut Schätzung des Lancet sterben in Indien rund 57.000 Säuglinge jährlich an einer Sepsis, die durch resistente Bakterien verursacht wurde.[3]
Werbegeschenke
Ein Sun Pharma Vertreter berichtete, dass sowohl informellen als auch registrierten ÄrztInnen hochwertige Geschenke gemacht würden, damit sie nicht zur Konkurrenzfirma wechseln. Die Firma sponsert Geschenkgutscheine, medizinische Geräte, Kühlschränke, Fernseher oder Reisen und bietet auch Bargeld oder kostenlose Medikamente als Anreiz, mehr Antibiotika zu verschreiben.
Sun Pharma ist der größte Arzneimittelproduzent in Indien, mit einem Umsatz von über 3,5 Mrd. € in 2018. Abbott India ist die zweitgrößte pharmazeutische Firma im Lande. Laut einem Vertreter von Abbott werden die ÄrztInnen mit Geschenken im Wert von bis zu 2.000 Rupien (25 €) geködert – in Indien eine Menge Geld. Die Firma bot außerdem „Kaufe fünf, bekomme eins gratis“-Deals für Antibiotika-Packungen an, um so Großeinkäufe zu fördern. In einem Land, in dem ÄrztInnen auch selbst Medikamente an die PatientInnen verkaufen dürfen, ein erheblicher Anreiz.
Indiens nicht-zertifizierte Ärztinnen verdienen so wenig, dass diese Anreize ihr monatliches Einkommen bis zu einem Viertel steigern können. Abbott bietet den ÄrztInnen zusätzlich ein Gefühl von Luxus mit Überraschungspartys für ihre Familien und Cocktail Soireen in fünf-Sterne Hotels. Offiziell lassen jedoch beide Firmen verlauten, dass ihre Policies derlei Werbepraktiken verbieten.
ExpertInnen und WissenschaftlerInnen kritisierten gegenüber dem Bureau of Investigative Journalism die Praktiken vehement. Lord Jim O’Neill, der ein Review zur globalen Resistenzproblematik durchgeführt hat, sagte: „Viele Pharmafirmen rühmen sich gerne, dass sie verantwortlich handeln und hier haben wir eindeutige Beweise, die das Gegenteil belegen.“
Professor Ramanan Laxminarayan, Direktor des Centre for Disease Dynamics, Economics and Policy (CDDEP), kommentierte: „Wenn man bedenkt, dass es in Indien fünfmal so viele informelle wie registrierte ÄrztInnen gibt, ist es nicht verwunderlich, dass durch sie die meisten Antibiotika an PatientInnen abgegeben werden. Es ist auch keine Überraschung, dass Pharmafirmen den Verkauf von Antibiotika ankurbeln. Notwendig ist ein Balanceakt, denn einerseits bieten diese informell Praktizierenden den Zugang zu Antibiotika, andererseits muss Über- und Fehlgebrauch vermieden werden. Genau darin liegt die Herausforderung.“
Krise des Gesundheitssystems
Indien ist das Epizentrum der Antibiotikaresistenz-Krise. MedizinerInnen warnen, dass sie regelmäßig PatientInnen mit „pan-resistenten“ Infektionen sehen, resistent gegenüber allen verfügbaren Medikamenten. Gleichzeitig kämpft das Land mit dem fehlenden Zugang zur Versorgung. Theoretisch steht armen PatientInnen in Indien eine kostenlose Gesundheitsversorgung zu. Doch im staatlichen Gesundheitssystem gibt es einen eklatanten Mangel an Fachpersonal. Ein aktueller Bericht des CDDEP ermittelte ein Defizit von 600.000 ÄrztInnen und zwei Millionen KrankenpflegerInnen im öffentlichen Sektor.
Problem informelle ÄrztInnen
Viele Menschen sind deshalb auf die mehr als 2,5 Millionen nicht-registrierten ÄrztInnen angewiesen. Sie praktizieren z.B. traditionelle Heilkunst, Ayurveda, Homöopathie oder Naturheilkunde und sind den rund eine Million privaten oder staatlichen ÄrztInnen mit einer anerkannten wissenschaftsbasierten medizinischen Ausbildung zahlenmäßig bei weitem überlegen.
Oft als „Onkel“ oder „chotto doctor“ (kleiner Doktor) bezeichnet, werden die informellen ÄrztInnen in ihren Gemeinden äußerst respektiert und auch zu allen Alltagsproblemen um Rat gefragt. Sie bieten ein wenig medizinische Versorgung in Regionen, die sonst komplett ohne Gesundheitsversorgung wären.
Dennoch sterben noch immer jedes Jahr mehr als eine halbe Million InderInnen an behandelbaren Infektionen, weil sie keinen Zugang zu Gesundheitsversorgung oder lebensrettenden Arzneimitteln haben.
Geschenke erhalten die Freundschaft
Pharmavertreter von Sun Pharma und Abbott, die mit einem verdeckten Bureau-Ermittler sprachen, machten kein Geheimnis daraus, dass sie sowohl nicht-zertifizierten als auch anerkannten ÄrztInnen Anreize anbieten. Weil Abbott in der Vergangenheit wegen teurer Geschenke für ÄrztInnen stark kritisiert wurde, hat die Firma Einschränkungen eingeführt – aber die Mitarbeiterinnen umgehen diese Regeln. Der Pharmavertreter erzählte, dass die Angestellten angewiesen wurden „es nicht offensichtlich zu machen“, aber dass Geschenke und Gratisproben immer noch gang und gäbe seien.
Geschenke an ÄrztInnen und nicht-zertifizierte ÄrztInnen sind auf 2.000 indische Rupien (25 €) begrenzt. Es werden jedoch auch wesentlich kostspieligere Anreize geboten, etwa die Teilnahme an Fortbildungsprogrammen oder Zahlungen an Dritte. Manche ÄrztInnen erhalten bis zu 20.000 Rupien (250 €) Honorar, wenn sie auf Konferenzen sprechen.
Bei Sun Pharma wird von den VertreterInnen gefordert, jeden Tag bis zu einem Dutzend ÄrztInnen zu besuchen, dabei ist es egal ob diese qualifiziert sind oder nicht. Die Hälfte ihrer 200 regelmäßigen KundInnen sind informelle ÄrztInnen. Sie werden häufig noch energischer angegangen als richtige ÄrztInnen. Der Sun Pharma-Vertreter beschreibt nicht-zertifizierte ÄrztInnen als „einfachen“ Markt für Antibiotika und als eine Hauptzielgruppe. Professionelle ÄrztInnen müssten davon überzeugt werden, wie sicher und effektiv ein Medikament ist, während nicht-zertifizierte ÄrztInnen meistens keine Erklärungen verlangten, lediglich Anreize.
„Du kannst geben was du willst,“ berichtet er. „Von einer Nadel bis zu einer Rakete kannst du anbieten was du willst. Sie werden es annehmen. Und je mehr du reinsteckst, desto höher wird der Umsatz sein […]. Es kann ein Fernseher sei. Es kann ein Kühlschrank sein. Es kann alles Mögliche sein.“
Das aggressive Marketing der Pharma-Vertreter beruht auch auf den Verkaufszielen, die vom Unternehmen gesetzt werden: Sun Pharma VertreterInnen bekommen Boni wenn sie monatlich Antibiotika und Schmerzmittel im Wert von mehr als 300.000 Rupien (ca. 3.800 €) verkaufen.
Firmen verteidigen sich
Abbott distanziert sich offiziell von solchen Praktiken. Eine Sprecherin der Firma betonte, dass es den Vertriebsteams verboten sei, ÄrztInnen oder ApothekerInnen irgendetwas von Wert als Anreiz zu geben, um den Umsatz zu steigern. Außerdem erhielten die Teams regelmäßig Trainings zu Ethik und Compliance. VertriebsmitarbeiterInnen würden sich „nur mit lizensiertem Gesundheitspersonal treffen, die dazu autorisiert sind, Medikamente zu verschreiben“.
Sun Pharma erklärte, dass sie „überrascht und traurig waren über die dargelegten Ansichten eines angeblichen Vertreters von Sun Pharma“. Der Sprecher der Firma fügte hinzu: „Wir können kategorisch ausschließen, dass die Ansichten dieser Person in irgendeiner Weise den Werten von Sun Pharma entsprechen. Die angeblichen Aktivitäten stehen im Gegensatz zu unseren Unternehmensstatuten.“ Es sei verboten, Geschenke an das Gesundheitspersonal abzugeben, die „darauf zielen, unangemessen die Entscheidung zu beeinflussen, Produkte zu verschreiben, empfehlen, erwerben, bereitzustellen oder auszugeben“. Personal, die diese Regel oder ein Gesetz brächen, müssten mit Disziplinarmaßnahmen oder Entlassung rechnen.
Expertin bestätigt Probleme
Dr. Meenakshi Gautham, Forscherin an der London School of Hygiene and Tropical Medicine mit Sitz in Indien, hat über 10 Jahre lang nicht-registrierte ÄrztInnen interviewt. Sie kommt zu dem Schluss, dass Pharmafirmen es zunehmend auf diese Zielgruppe abgesehen haben und aggressiv Antibiotika vermarkten. „Pharma-Vertreter haben mir erzählt, wenn sie in manchen Gegenden das Ziel haben, Antibiotika im Wert von 100.000 Rupien (1.260 €) zu verkaufen, stammen 80.000 davon aus Verkäufen an informelle AnbieterInnen und 20.000 von registrierten ÄrztInnen.“
Gauthams Forschungsergebnisse zeigen, dass die meisten nicht-zertifizierten und privaten ÄrztInnen ihre gesamten Informationen über Antibiotika von PharmavertreterInnen und Pharmafirmen erhalten oder durch gesponserte Konferenzen. Ein Problem seien auch Gratisproben von Antibiotika, die die informellen ÄrztInnen erhalten. Sie geben die Proben dann häufig kostenlos an arme PatientInnen weiter. Doch die Proben reichen für gewöhnlich nicht für den kompletten Behandlungszyklus, die PatientInnen können damit also nicht ausreichend therapiert werden und der Resistenzbildung wird Vorschub geleistet.
Um die Probleme effektiv bekämpfen zu können, müssten solche aggressiven Vermarktungsstrategien der Firmen gestoppt werden. Erst dann kann es gelingen, in Zusammenarbeit mit den informellen Anbietern von Gesundheitsdienstleistungen den Antibiotika-Gebrauch zu reduzieren.
Über die AutorInnen:
Madlen Davies ist eine preisgekrönte Investigativjournalistin aus Großbritannien. Sie arbeitet für das Bureau of Investigative Journalism in Großbritannien. Einer ihrer Themenschwerpunkte sind die Gesundheitsrisiken durch resistente Erreger weltweit.
Ben Stockton ist britischer Investigativjournalist. 2019 gewann er gemeinsam mit Madlen Davies den Association of British Science Writers Preis. Beide wurden insbesondere für ihre Arbeit zu multiresistenten Keimen ausgezeichnet.
Rahul Meesaraganda arbeitet als unabhängiger Journalist in Andhra Pradesh, Indien. Seine Themenschwerpunkte sind Landwirtschaft, Umwelt und Wasser, mit einem Fokus auf die Situation in ländlichen Regionen. Auch zu Antibiotika-Resistenzen hat er bereits mehrere Berichte veröffentlicht, die internationale Aufmerksamkeit erlangten.
Madlen Davies & Rahul Meesaraganda sind PartnerInnen der BUKO Pharma-Kampagne im aktuellen Projekt zu Antibiotikaresistenzen.
Übersetzung: Hannah Eger
Bearbeitung: CJ/JS
Bilder © Madlen Davies
Artikel aus dem Pharma-Brief 10/2019, S. 1
[1] www.thebureauinvestigates.com
[2] www.thebureauinvestigates.com/stories/2019-08-19/drug-company-reps-give-quack-doctors-fridges-and-televisions-to-sell-antibiotics
[3] Laxminarayan R and Bhutta ZA (2016) Antimicrobial resistance - a threat to neonate survival. The Lancet Global Health; 4, p. e676
Aussichten auf eine gesunde Zukunft!
Jahresbericht der Pharma-Kampagne 2019
2019 war ein schwieriges Jahr für die BUKO Pharma-Kampagne. Weil mehrere große Projektanträge gescheitert waren, mussten wir Stellen kürzen und zwei MitarbeiterInnen entlassen, von denen wir nur eine wieder einstellen konnten. Monatelang hatten wir mit Liquiditätsengpässen zu kämpfen. Die Krise dauerte bis zur Jahresmitte, sie hat sämtliche Finanzreserven verschlungen und auch an unseren Kräften gezehrt. Denn trotz der miserablen Finanzlage haben wir bei unserer Bildungsarbeit und der politischen Arbeit kaum Abstriche gemacht.
Mit neun Veranstaltungen hat sich die Kampagne 2019 in die Klimadebatte eingemischt und dabei die globalen Gesundheitsrisiken zunehmender Erwärmung deutlich gemacht. An mehreren Pflegeschulen haben wir unsere Schulmaterialien zum Thema eingesetzt und sie über diverse Bildungsserver kostenlos zur Verfügung gestellt.
Auch HIV/Aids stand ganz oben auf unserer Agenda. Denn Stigmatisierung, Kriminalisierung und hohe Medikamentenpreise schließen immer noch viele Menschen von Prävention und Behandlung aus. Ein neuer E-Learning-Kurs dazu ist seit April 2019 in Arbeit und wird Mitte nächsten Jahres online gehen.
Ein Pharma-Brief Spezial erschien in Kooperation mit dem Aktionsbündnis gegen Aids (AgA) und analysiert den Status Quo im Kampf gegen die Immunschwäche-Krankheit.
Weltweit vernetzt mit starken Partnern
Im Mai 2019 startete ein zweijähriges Bildungsprojekt zur weltweiten Problematik von Antibiotika-Resistenzen. Gemeinsam mit Partnerorganisationen in Indien, Tansania und Südafrika untersuchten wir die Resistenz-Situation in den Bereichen Humanmedizin, Landwirtschaft und Umwelt. Wir beleuchteten Ursachen und Wechselwirkungen, aber auch politische Strategien und lokale Handlungsansätze. Unsere Länderstudien basieren auf intensiven Literaturrecherchen. Zusätzlich entwickelten wir in Zusammenarbeit mit unseren Partnern Fallbeispiele, die die ABR-Problematik anschaulich machen sollen und spezifische lokale Herausforderungen aufzeigen. Unsere Partner führten zu diesen Aspekten Interviews mit diversen Akteuren – z.B. aus Medizin, Pharmazie und Landwirtschaft - und zeichneten die Gespräche als Videos auf. Die Länderstudien werden wir ab Jahresmitte in einer multimedialen Wanderausstellung präsentieren und auch einen Pharma-Brief Spezial dazu veröffentlichen.
Kritische Analysen fanden Widerhall
Trotz der Finanzmisere im vergangenen Jahr lieferte die Pharma-Kampagne bei ihrer Presse- und Öffentlichkeitsarbeit die gewohnte Quantität und Qualität: Wir waren an rund 60 Veranstaltungen beteiligt, besuchten Tagungen, referierten bei Konferenzen im In- und Ausland, hielten Vorlesungen, organisierten Fachgespräche oder Workshops. Wir publizierten 8 Pharma-Briefe und 2 Pharma-Briefe Spezial, standen 33 JournalistInnen Rede und Antwort, führten Interviews und Hintergrund-Gespräche oder vermittelten Kontakte zu ExpertInnen.
Insgesamt gingen 47 Medienberichte aus unserer Pressearbeit hervor. Themen waren u.a. Klimawandel und globale Gesundheit, die Resolution der Weltgesundheitsversammlung zu Transparenz im Arzneimittelmarkt, aber auch Blutplasmahandel, Krebsmedikamente oder Qualitätsprobleme bei Arzneirohstoffen. Nicht zuletzt entfachte unsere kritischen Analyse zum Global Health Hub Germany ein beachtliches Medienecho: Unsere Stellungnahme floss in Briefing-Papiere von NGOs und parteipolitische Statements ebenso ein wie in die Berichterstattung der Fachzeitschrift The Lancet und des Deutschen Ärzteblatt.
Zum Jahresende deckten wir gemeinsam mit der britischen Organisation TranspariMED auf, dass deutsche Unikliniken die Ergebnisse ihrer klinischen Studien häufig nicht zeitgerecht oder gar nicht veröffentlichen. Süddeutsche, Tagesschau, Deutschlandfunk, Spiegel und andere Leitmedien berichteten daraufhin über die Missstände.
Kritische Analysen, gute Argumente und öffentlicher Druck haben Einfluss auf die Arzneimittel- und Gesundheitspolitik. Die BUKO Pharma-Kampagne ist hier trotz ihrer geringen Größe und begrenzten Mittel eine gewichtige Akteurin. Auch damit schaffen wir bessere Aussichten für eine gesunde Zukunft.
Doch unsere Finanzmisere 2019 hat einmal mehr gezeigt, wie wichtig Spenden und Förderbeiträge sind, um unsere Arbeit zu finanzieren und uns Planungssicherheit zu geben – erst recht in einem rauer werdenden politischen Klima. Wir danken allen, die uns im vergangenen Jahr mit großzügigen Spenden und Beiträgen wieder auf die Beine geholfen haben. Bitte denken Sie doch einmal darüber nach, ob es auch Ihnen möglich ist, Fördermitglied zu werden oder ihren Förderbeitrag um ein paar Euro zu erhöhen – damit wir auch morgen kein Blatt vor den Mund nehmen müssen. (CJ)
Artikel aus dem Pharma-Brief 1/2020, S.6
Bild © Jason Weingart
Gifte und Gene
Neue Forschung zu Antiseren
Schlangenbisse sind ein weit verbreitetes aber vernachlässigtes Problem. Gegengifte sind oft nicht verfügbar, zu teuer oder ungeeignet. Einige positive Impulse kamen zuletzt von der WHO und aus der Forschung.
2020, das chinesische Jahr der Ratte, begann ausgerechnet mit Neuigkeiten aus der Welt der Schlangen. Ein internationales Forscherteam vermeldete Anfang Januar, das vollständige Genom der Asiatischen Kobra (Abbildung) entschlüsselt zu haben.[1] Ihr Fokus galt dabei der Giftproduktion des Tieres, die eine besondere Relevanz hat: Die Kobra gehört zu den sogenannten „Big Four“, die vier Giftschlangen, auf die nach Schätzungen die meisten Bisse in Indien entfallen.
Vergiftungen durch Schlangenbisse, ein uraltes Problem, haben global erst in jüngster Zeit größere Aufmerksamkeit erhalten. Noch 2013 hatte die Weltgesundheitsorganisation (WHO) Schlangenbisse von ihrer Liste vernachlässigter Tropenkrankheiten entfernt, 2017 kehrten sie darauf zurück.[2] Auch wegen des Einsatzes zivilgesellschaftlicher Akteure begann die WHO das Thema stärker zu bearbeiten. 2019 präsentierte sie dann eine ambitionierte Bekämpfungsstrategie mit dem Ziel, bis 2030 die Zahl von Todesfällen und Invalidität durch Schlangenbisse bis 2030 zu halbieren.[3] Im Vorfeld der Veröffentlichung kündigte zudem der Wellcome Trust ein Investment von über 100 Mio. US-Dollar für ein siebenjähriges Forschungsprogramm für bessere Antiseren an.[4]
Menschen und Tiere gefährdet
Weltweit gibt es mehrere hundert giftige Arten des Reptils. Schätzungen zufolge, werden täglich über 7.000 Menschen von Schlangen gebissen, pro Jahr sterben zwischen 81.000 und 138.000 am Gift.[5] Das Problem ist besonders in Afrika und Asien drängend, Indien ragt dabei hervor.
Es trifft zumeist die ärmsten Bevölkerungsteile, etwa Erwachsene bei der Ernte oder beim Fischen, sowie Kinder beim Spielen. Überleben sie, tragen sie häufig schwerwiegende Folgeverletzungen davon, da sie etwa erblinden oder Amputationen notwendig werden. Neben den sozialen Implikationen hat dies für viele Familien auch ökonomische Konsequenzen. Dies gilt umso mehr, bedenkt man gemäß des One Health-Ansatzes, dass auch Nutztiere häufig gebissen werden.[6] Im Übrigen gefährdet diese Situation auch die Schlangen selbst, da sie, wenn gesichtet, oft direkt getötet werden.
Marktversagen im Fokus
Verfügbarkeit, Bezahlbarkeit und Eignung von Antiseren, die im Falle einer Vergiftung Anwendung finden könnten, sind teils massiv eingeschränkt. Dies hat vielfältige Ursachen.
Eine Wurzel des Problems liegt im Marktversagen.[7] Zwar besteht ohne Zweifel umfangreicher Bedarf an Antiseren und einige Gifte werden beispielsweise auch seit Längerem getestet – allerdings in der Krebsforschung. Es mangelt an finanzierbaren Präparaten. Für die Pharma-Industrie sind die von Bissen Betroffenen als Kundenkreis nicht zahlungskräftig genug. Auch viele Länder scheuen vor den hohen Anschaffungskosten zurück, was für Firmen wiederum weniger Abnehmer bedeutet.[8]
So nehmen Produktionskapazitäten ab. Für Aufsehen sorgte 2015 das Ende der Herstellung des gut erprobten Fav-Afrique durch Sanofi. Import ist zudem teuer, Produktion vor Ort selten – die in Kenia eingesetzten Gegengifte etwa kommen aus Mexiko und Indien.[9]
Kobra ist nicht gleich Kobra
Verschärfend zu den Preishürden und letztlich auch mit dem Marktversagen zusammenhängend, kommt die oftmals geringe (lokale) Eignung. Zum einen sind in vielen Ländern Produkte auf den Markt gelangt, die wenig getestet, teils sogar unnütz oder gefährlich sind. Ein Umstand, der auch Misstrauen in der Bevölkerung schürt. Zum anderen unterscheidet sich die Wirkweise von Giften nicht nur zwischen Schlangenarten in verschiedenen Regionen, sondern mitunter auch national und teils sogar zwischen einzelnen Exemplaren derselben Art. Eine 2019 veröffentlichte Studie zeigte, dass in Indien, Heimat von über 60 verschiedenen Giftschlangenarten, routinemäßig ein auf die „Big Four“ zugeschnittenes Gegengift verwendet wird, obwohl es für viele andere Arten ungeeignet ist.[10] Umso größer kann der Effekt öffentlicher Forschungsförderung sein, entsprechende Projekte sind weltweit zu finden.
Hier setzt die Arbeit der eingangs genannten Genom-Analyse an. So besteht die Hoffnung, dass durch mehr solcher Mappings der an der Giftherstellung beteiligten Gene und Prozesse auf lange Sicht die Herstellung zielgerichteter, synthetischer Antiseren befördert wird. Diese könnten im besten Falle sogar als „Breiband-Antivenom“ gegen mehrere Arten wirken und günstiger sein.[11] Voraussichtlich ließen sich auf diesem Wege zusätzlich die Risiken allergischer Reaktionen vermindern. Sie entstehen bei PatientInnen infolge der seit über hundert Jahren genutzte Technik, Antikörper aus immunisierten Tieren zu gewinnen.
Communities einbeziehen
Abseits der medizinischen Lösungen und der Verfügbarkeit von Antiseren selbst, bedarf es für die Zukunft auch Bemühungen, die Infrastruktur zu verbessern. Bessere Basisversorgung im Sinne von Universal Health Coverage und geschultes Gesundheitspersonal sollten dann begleitende Behandlung ermöglichen, beispielsweise wenn infolge später Diagnose eine Operation unausweichlich wird. Auch Aufklärung ist vonnöten, sie muss breit ansetzen. Prävention ist ein Aspekt, etwa das Tragen von Schuhen oder die Bekämpfung von Nagetieren in Siedlungen. Auch das Bestimmen von Schlangenarten und das richtige Reagieren auf Bisse ist wichtig. Letztgenanntes vor allem zur Vermeidung nicht intendierter Selbstverletzungen und möglicher negativer Auswirkungen von traditioneller Medizin. Der Einbezug von Communities ist elementar, um Mitbestimmung zu gewähren, aber auch um lokales Wissen zu nutzen und eine bessere Datenlage zu schaffen.
Die Zeit für adäquate Lösungen drängt. Vieles spricht dafür, dass sich das Problem in zahlreichen betroffenen Gegenden in Zukunft verschärfen wird. Bevölkerungswachstum, das weitere Eindringen in natürliche Habitate der Reptilien mit Abholzung, Siedlungsbau und intensivierte Landwirtschaft sind dabei wichtige Aspekte. Auch Klimaveränderungen können sich negativ auswirken, im globalen Süden, wie auch im Norden. So haben Urbanisierung und erhöhter Regenfall auch in US-Bundesstaaten wie Georgia und Texas die Fallzahlen bei Schlangenbissen zuletzt nach oben getrieben.[12] (MK)
Artikel aus dem Pharma-Brief 1/2020, S.4
Bild © Dr. Raju Kasambe
[1] Zwar war bereits 2013 ähnliches für die Königskobra gelungen, allerdings weniger detailliert.
[2] Chippaux J-P (2017) Snakebite envenomation turns again into a neglected tropical disease! Journal of Venomous Animals and Toxins including Tropical Diseases; 23, p 38
[3] WHO (2019) Snakebite envenoming: a strategy for prevention and control. www.who.int/snakebites/resources/9789241515641/en/ [Zugriff 20.01.2020]
[4] Schiermeier Q (2019) Snakebite crisis gets US$100-million boost for better antivenoms. Nature news 16 May https://doi.org/10.1038/d41586-019-01557-0 [Zugriff 20.01.2020]
[5] Minghui R et al. (2019) WHO’s Snakebite Envenoming Strategy for prevention and control. Lancet Global Health; 7, p e837 http://dx.doi.org/10.1016/S2214-109X(19)30225-6
[6] Bolon I et al. (2019) Snakebite in domestic animals: First global scoping review. Preventive Veterinary Medicine; 170, 104729 https://doi.org/10.1016/j.prevetmed.2019.104729
[7] Habib AG and Brown NI (2018) The snakebite problem and antivenom crisis from a health-economic perspective. Toxicon; 150, p 115 https://doi.org/10.1016/j.toxicon.2018.05.009
[8] MSF (2019) Antivenom, not frogs, needed to cure snakebite. www.msf.org/antivenom-not-frogs-needed-cure-snakebite-south-sudan [Zugriff 20.01.2020]
[9] Reuters (2019) Kenyan team aim to fight fatal snakebite. www.reuters.com/article/us-kenya-snakes/kenyan-team-aim-to-stop-fatal-snake-bites-idUSKBN1X813Y [Zugriff 20.01.2020]
[10] Senji Laxme RR et al. (2019) Beyond the ‘big four’: Venom profiling of the medically important yet neglected Indian snakes reveals disturbing antivenom deficiencies. PLoS Negl Trop Dis; 13, p e0007899 https://doi.org/10.1371/journal.pntd.0007899
[11] Willems W (2019) Todbringende Gene. Süddeutsche Zeitung 13. Januar www.sueddeutsche.de/wissen/schlangen-todbringende-gene-1.4754644 [Zugriff 20.01.2020]
[12] Bauerlein V (2019) Snakebites Hit Record Highs in Southern States as Suburbs Expand. Wall Street Journal, 5 Aug. www.wsj.com/articles/snakebites-hit-record-highs-in-southern-states-as-suburbs-expand-11565006405 [Zugriff 20.01.2020]
Pharma-Brief Spezial
Hier finden Sie eine separate Auflistung des Pharma-Brief Spezial. Dies sind Sonderausgaben, die sich auf unterschiedliche Themenschwerpunkte konzentrieren.
Pharma-Brief Archiv
Pharma-Brief Archiv
Unsere Fachzeitschrift Pharma-Brief erscheint acht Mal pro Jahr und bietet gut recherchierte Beiträge rund um das Thema globale Gesundheit. Sie informiert über Zugangsprobleme bei Medikamenten, Arzneimittelrisiken und Nutzenbewertung, mangelnde Transparenz des Arzneimittelmarktes, vernachlässigte Krankheiten, illegale Pharmageschäfte, internationale Gesundheitspolitik und auch über Projekte der BUKO Pharma-Kampagne. Zweimal jährlich erscheint außerdem eine Doppelausgabe mit dem Pharma-Brief Spezial als Beilage. Die Broschüren beleuchten jeweils ein Schwerpunktthema.
Abonnieren Sie den Pharma-Brief und bleiben Sie auf dem Laufenden!
Sie können hier alle Jahrgänge des Pharma-Briefes ab 1981 online lesen.

